题目内容
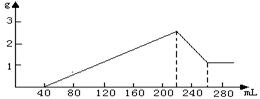 某合金经分析知含有Fe、Al、Si三种单质,为测定合金的组成,某课外小组取一定量的合金与500mL稀H2SO4反应,生成aL标况下的H2,反应溶液经过滤后,向滤液中加适量的硝酸钾恰好使溶液中的Fe2+全部氧化(还原产物只有NO),再向其中加入0.5mol/L的NaOH溶液,所加NaOH溶液体积与产生沉淀的质量变化如图所示。另再取相同质量量的合金,与足量的NaOH反应,也产生aL标况下的H2。
某合金经分析知含有Fe、Al、Si三种单质,为测定合金的组成,某课外小组取一定量的合金与500mL稀H2SO4反应,生成aL标况下的H2,反应溶液经过滤后,向滤液中加适量的硝酸钾恰好使溶液中的Fe2+全部氧化(还原产物只有NO),再向其中加入0.5mol/L的NaOH溶液,所加NaOH溶液体积与产生沉淀的质量变化如图所示。另再取相同质量量的合金,与足量的NaOH反应,也产生aL标况下的H2。
试求:(1)所加硝酸钾的物质的量
(2)合金中各种单质的质量分数
(3)所加稀硫酸的物质的量浓度
(1)mol(2)Al%=43.5%(1分)Fe%=45.2%(1分)Si%=11.3%(1分) (3)mol/L
解析:
根据图中可知,溶解氢氧化铝沉淀用去40mL NaOH溶液。沉淀Fe3+和Al3+用去NaOH溶液100mL。由此可算氢氧化铝的物质的量和氢氧化铁的物质的量,又因为合金与酸反应和与碱反应产生的H2体积相等,故硅的物质的量为铁的物质的量的一半。三种单质的物质的量知道就可计算第(1)、(2)两个问;第(3)问要求出与金属反应用去的酸和NO3-存在下与Fe2+反应用去的H+及最后与NaOH反应的酸。
由图可知:n(Al)=0.04L×0.5mol/L=0.02mol…………………0.5分
n(Fe)=(0.180L-0.120L)×0.5÷3=0.01mol…………… ………0.5分
∵与酸、碱反应生成的H2体积相等
∴n(Si)=n(Fe)==0.005mol………………………………1分
Fe2+加KNO3 后发生如下反应:
3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
3mol 1mol 4mol
∴ n(KNO3)=mol ………………………………………1分
合金的总质量为:
n(Al)×M(Al)+n(Fe)×M(Fe)+n(Si)×M(Si)
=0.02mol×27g/mol+0.01mol×56g/mol+0.005mol×28g/mol=1.24g……1分
∴Al%=×100%=43.5%…………………………1分
Fe%=×100%=45.2%…………………………1分
Si%=×100%=11.3%…………………………1分
![]()
![]() 与金属反应:n(H2SO4)=n(Fe)+n(Al)=0.01+0.03=0.04mol
与金属反应:n(H2SO4)=n(Fe)+n(Al)=0.01+0.03=0.04mol
H2SO4 与NO3-、Fe2+反应:n(H2SO4)=n(Fe)=mol 2分
与NaOH反应:n(H2SO4)=0.04L×0.5mol/L÷2=0.04mol
∴所加硫酸的物质的量浓度为:(mol+0.04mol+0.04mol)÷0.5L=mol/L
……………………………………………………………………1分

 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案某溶液经分析只含有Na+、K+、Ca2+、Cl-、 ,已知其中Na+、K+、Ca2+、
,已知其中Na+、K+、Ca2+、 的浓度均为0.2mol·L-1,则Cl-的物质的量浓度为( )
的浓度均为0.2mol·L-1,则Cl-的物质的量浓度为( )
| A.0.6mol·L-1 | B.0.5mol·L-1 | C.0.4mol·L-1 | D.0.3mol·L-1 |
 ,已知其中Na+、K+、Ca2+、
,已知其中Na+、K+、Ca2+、