题目内容
【题目】S2Cl2是工业上常用的硫化剂,已知S2C12中硫元素显+1价,它不稳定,在水中易发生岐化反应,易溶于有机溶剂。实验室常用CS2与纯净的氯气制备S2C12。反应涉及到的几种物质的熔沸点如下:
物质 | CS2 | Cl2 | CCl4 | S2C12 |
沸点/℃ | 47 | -34.6℃ | 77 | 137 |
熔点/℃ | -109 | -100.98℃ | -23 | -77 |
实验室利用下列装置制备S2C12 (部分夹持仪器己略去):
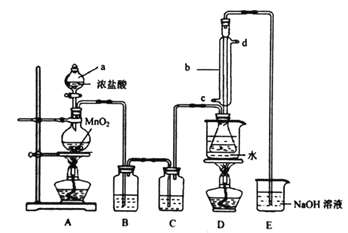
回答下列问题:
(1)装置中b玻璃仪器的名称为_______;写出制备S2C12的化学方程式_______。
(2)整套装置装配完毕后,首先进行的操作是________,再添加试剂。
(3)实验中盐酸试剂通常采用36.5%的浓盐酸,不用稀盐酸的理由是________。
装置A中反应的离子方程式是___________。
(4) D中采用热水浴加热的原因是__________,反应结束后从锥形瓶内混合物中分离出产品的方法是_______________。
(5)实验过程中,若缺少C装置,则发现产品浑浊不清,出现该现象的原因化学方程式表示为__________。
(6)该实始装置设计存在缺陷,你的改进建议及改进目的是_______________。
【答案】 冷凝管 CS2+3Cl2![]() CCl4+S2Cl2 检查气密性 稀盐酸的还原性弱于浓盐酸的还原性,不能被二氧化锰氧化生成氧气 MnO2+4H++2Cl-
CCl4+S2Cl2 检查气密性 稀盐酸的还原性弱于浓盐酸的还原性,不能被二氧化锰氧化生成氧气 MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 使气化蒸馏 2S2Cl2+2H2O=3S↓+SO2↑+4HCl 在D和E之间增加干燥装置 进入锥形瓶引起产物S2Cl2水解
Mn2++Cl2↑+2H2O 使气化蒸馏 2S2Cl2+2H2O=3S↓+SO2↑+4HCl 在D和E之间增加干燥装置 进入锥形瓶引起产物S2Cl2水解
【解析】(1)根据仪器的结构可知装置中b玻璃仪器的名称为冷凝管;CS2遇Cl2在加热条件下生成S2C12和CCl4的化学方程式为CS2+3Cl2![]() CCl4+S2Cl2 ;
CCl4+S2Cl2 ;
(2)整套装置装配完毕后,应先进行气密性的检查,再添加试剂.;
(3)实验中盐酸通常采用36.5%的浓溶液,不用稀盐酸,因为稀盐酸还原性弱,反应困难;用固液加热的方法制Cl2,常用浓盐酸和二氧化锰反应制取,反应离子方程式为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(4) 根据表中物质的沸点高低,为了使CS2平稳汽化,避免产物S2Cl2汽化,可以采用水浴加热的方法,结束后从锥形瓶内混合物中分离出S2Cl2的方法是蒸馏,控制温度在137℃;
(5)S2Cl2与水反应,有无色刺激性气味气体产生,并有黄色沉淀生成,无色刺激性气味气体除氯化氢外,依据氧化还原反应的元素化合价变化守恒推断,化合价降低的生成黄色沉淀为单质硫,化合价升高的生成二氧化硫气体,依据原子守恒、电子守恒写出化学方程式为:2S2Cl2+2H2O=3S↓+SO2↑+4HCl↑;
(6)S2Cl2易水解,在D和E之间增加干燥装置,防止水蒸汽进入锥形瓶引起产物S2Cl2水解。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案