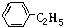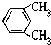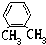题目内容
14.R、M、T、G、J为原子序数依次递增的同一短周期主族元素,下列说法一定正确的是(m、n均为正整数)( )| A. | 若M的最高正化合价为+4,则五种元素都是非金属元素 | |
| B. | HnJOm为强酸,则G是位于ⅤA族以后的活泼非金属元素 | |
| C. | 若T的最低化合价为-3,则J的最高正化合价为+7 | |
| D. | 若R、M的最高价氧化物的水化物均为碱,则R(OH)n的碱性一定比M(OH)n+1的碱性强 |
分析 同周期元素的原子,从左到右,元素的金属性从强到弱,非金属性增强,最高价氧化物对应的水化物碱性越来越弱,酸性越来越强,最高正价从+1升到+7价,最高正价等于最外层电子数,以此来解答.
解答 解:A.若M的最高正化合价为+4,则M为ⅣA族元素,R可能为Al,则五种元素不一定都是非金属元素,故A错误;
B.同周期元素的原子,从左到右,元素的非金属性越来越强,最高价氧化物对应的水化物酸性越来越强,HnJOm为强酸,J为S或Cl,则G是位于ⅤA族以后的活泼非金属元素,故B正确;
C.若T的最低化合价为-3,则T为为ⅤA族元素,所以最外层电子数为5,由原子序数依次递增,则J的最外层电子数为7,最高正化合价为+7,故C正确;
D.同周期元素从左到右元素的金属性逐渐减弱,对应的最高价氧化物的水化物的碱性逐渐减弱,故D正确;
故选:CD.
点评 本题考查元素周期表及元素周期律,明确同周期原子序数依次递增是解答本题的关键,熟悉位置、性质的关系即可解答,题目难度不大.

练习册系列答案
相关题目
2.下列组合中,中心离子的电荷数和配位数均相同的是( )
| A. | K[Ag(CN)2]、[Cu(NH3)4]SO4 | B. | [Ni(NH3)4]Cl2、[Ag(NH3)2]Cl | ||
| C. | [Ag(NH3)2]Cl、[Cu(NH3)2]Cl2 | D. | [Ni(NH3)4]Cl2、[Cu(NH3)4]SO4 |
9.下列变化需克服相同类型作用力的是( )
| A. | 碘和干冰的升华 | B. | 硅和冰的熔化 | ||
| C. | 氯化氢和氯化钾的溶解 | D. | 氯化钠和冰融化 |
19.25℃时,弱酸的电离平衡常数如表:下列有关说法正确的是( )
| 弱酸 | CH3COOH | HCN | H2CO3 |
| Ka | 1.8×10-8 | 4.9×10-10 | K1;4.3×10-7 K2:5.6×10-11 |
| A. | 等物质的量浓度的各溶液的pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) | |
| B. | a mol/L HCN与b mol/L NaOH溶液等体积混合后所得溶液中c(Na+)>c(CN-),则a一定小于b | |
| C. | 往冰醋酸中逐滴加水,溶液导电能力先增大,后减小 | |
| D. | NaHCO3和Na2CO3的混合液中:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
6.下列表示物质结构的化学用语正确的是( )
| A. | 氯化氢的电子式: | B. | CO2的结构式:O=C=O | ||
| C. | 硫离子结构示意图: | D. | CCl4的电子式: |

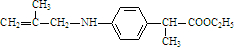 .
.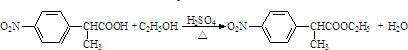 .
.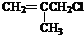 有相同官能团的同分异构体有10种.(要求考虑顺反异构)
有相同官能团的同分异构体有10种.(要求考虑顺反异构)