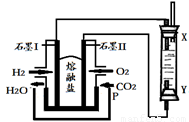
题目内容
①用FeCl3溶液腐蚀电路板的离子方程式:________.
②红热的炭与浓硫酸反应的化学方程式:________.
③SO2催化氧化成SO3的化学方程式:________.
2Fe3++Cu=2Fe2++Cu2+ C+2H2SO4 CO2↑+2SO2↑+2H2O 2SO2+O2
CO2↑+2SO2↑+2H2O 2SO2+O2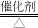 2SO3
2SO3
分析:①氯化铁溶液和电路板上的铜反应生成氯化亚铁和氯化铜;
②红热的炭与浓硫酸加热反应生成二氧化硫和二氧化碳、水;
③SO2催化氧化成SO3的是可逆反应.
解答:①FeCl3溶液腐蚀电路板的离子方程式为:2Fe3++Cu=2Fe2++Cu2+,故答案为:2Fe3++Cu=2Fe2++Cu2+;
②红热的炭与浓硫酸反应的化学方程式为:C+2H2SO4 CO2↑+2SO2↑+2H2O,故答案为:C+2H2SO4
CO2↑+2SO2↑+2H2O,故答案为:C+2H2SO4 CO2↑+2SO2↑+2H2O;
CO2↑+2SO2↑+2H2O;
③SO2催化氧化成SO3的化学方程式为:2SO2+O2 2SO3,故答案为:2SO2+O2
2SO3,故答案为:2SO2+O2 2SO3.
2SO3.
点评:本题考查了化学方程式的书写注意问题,主要是反应条件,产物判断,关键是二氧化硫催化氧化为三氧化硫的反应是可逆反应.
 CO2↑+2SO2↑+2H2O 2SO2+O2
CO2↑+2SO2↑+2H2O 2SO2+O2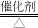 2SO3
2SO3分析:①氯化铁溶液和电路板上的铜反应生成氯化亚铁和氯化铜;
②红热的炭与浓硫酸加热反应生成二氧化硫和二氧化碳、水;
③SO2催化氧化成SO3的是可逆反应.
解答:①FeCl3溶液腐蚀电路板的离子方程式为:2Fe3++Cu=2Fe2++Cu2+,故答案为:2Fe3++Cu=2Fe2++Cu2+;
②红热的炭与浓硫酸反应的化学方程式为:C+2H2SO4
 CO2↑+2SO2↑+2H2O,故答案为:C+2H2SO4
CO2↑+2SO2↑+2H2O,故答案为:C+2H2SO4 CO2↑+2SO2↑+2H2O;
CO2↑+2SO2↑+2H2O;③SO2催化氧化成SO3的化学方程式为:2SO2+O2
 2SO3,故答案为:2SO2+O2
2SO3,故答案为:2SO2+O2 2SO3.
2SO3.点评:本题考查了化学方程式的书写注意问题,主要是反应条件,产物判断,关键是二氧化硫催化氧化为三氧化硫的反应是可逆反应.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
金属及其化合物的应用很广泛,现举几种常见金属及其化合物的用途,回答有关问题:
(1)FeCl3溶液常用于腐蚀印刷电路铜板,其离子方程式为:_______________________________。
(2)黄铜矿熔炼后得到的粗铜中含少量Fe、Ag、Au等金属杂质,需进一步采用电解法精制。请简述粗铜电解得到精铜的原理:_________________________________________。
(3)某科研人员发现劣质不锈钢在酸中腐蚀缓慢,但在某些盐溶液中腐蚀现象明显。请从下表提供的药品中选择两种(水可任选),设计最佳实验,验证劣质不锈钢易被腐蚀。
|
浓硫酸、稀硫酸、CuO、NaOH溶液 |
有关反应的化学方程式____________________________________________________。
劣质不锈钢腐蚀的实验现象________________________________________________。
(4)合金在生活和生产上用途越来越广泛。请用相关的知识解释在航空业上铝合金比铁合金用途更广泛的原因。
金属及其化合物的应用很广泛,现举几种常见金属及其化合物的用途,回答有关问题:
(1)FeCl3溶液常用于腐蚀印刷电路铜板,其离子方程式为:________。
(2)黄铜矿熔炼后得到的粗铜中含少量Fe、Ag、Au等金属杂质,需进一步采用电解法精制。请简述粗铜电解得到精铜的原理:________。
(3)某科研人员发现劣质不锈钢在酸中腐蚀缓慢,但在某些盐溶液中腐蚀现象明显。请从下表提供的药品中选择两种(水可任选),设计最佳实验,验证劣质不锈钢易被腐蚀。
| 浓硫酸、稀硫酸、CuO、NaOH溶液 |
劣质不锈钢腐蚀的实验现象________。
(4)合金在生活和生产上用途越来越广泛。请用相关的知识解释在航空业上铝合金比铁合金用途更广泛的原因。
 O2(g)
O2(g) FeO(s)
△H=-272 kJ·mol-1
FeO(s)
△H=-272 kJ·mol-1  Fe(s)+CO2(g) △H=
。
Fe(s)+CO2(g) △H=
。