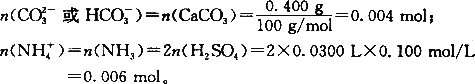题目内容
有一瓶白色固体,取少量置于试管中加热,固体逐渐消失,放出水蒸气和其他两种气体,试管内除管口有少量水珠外,没有任何残留物.取0.350 g这种固体跟过量的碱液反应,生成一种能使湿润红色石蕊试纸变蓝的气体,这些气体正好能和30.0 mL 0.100 mol/L H2SO4完全反应;另取0.350 g该固体跟足量盐酸反应,放出一种无色、无臭的气体,将这些气体通入过量的澄清石灰水中,得到0.400 g白色沉淀.
(1)计算0.350 g固体中含有的阴离子和阳离子的物质的量.
(2)根据实验及计算结果确定白色固体是什么?写出判断的依据.
答案:
解析:
解析:
|
解析:(1)固体与碱液共热时放出能使湿润红色石蕊试纸变蓝的气体,证明有
(2)因为固体加热分解后试管内没有任何残留物,以及除水蒸气之外只有两种气体生成,说明该固体中不含任何固体金属离子和其他酸根离子.所以该固体可能是(NH4)2CO3和NH4HCO3. 在(NH4)2CO3中, 评注:①NH3被H2SO4完全吸收的反应为:2NH3+H2SO4=(NH4)2SO4,故有关系式:n( |

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目