题目内容
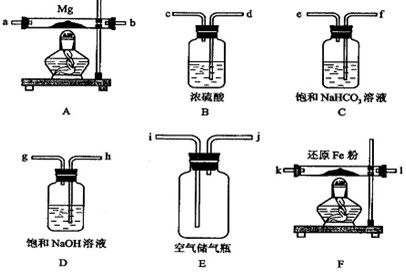
在实验室里制取少量FeCl3,可按照一定顺序连接下图中所列装置,所通过的气体过量且反应充分.试回答以下问题:

(1)实验时,各装置接口的连接顺序为______(用a、b、c、d等字母表示);
(2)C装置的作用是______;
(3)D装置的作用是______;
(4)检验B装置中反应后铁是否有剩余的方法是:______;
(5)用此方法可制得无水氯化铁.你认为能否改用Fe和盐酸反应,再通入过量氯气、蒸干溶液的方法来制取无水氯化铁,______(答:是或否);说明理由:______.
解:(1)制备氯气中含有氯化氢和水蒸气,有水蒸气不能制的氯化铁,除去水蒸气用浓硫酸,应先除去水蒸气干燥,干燥的氯气通入玻璃管中和铁反应生成无水氯化铁,最后吸收尾气中未反应的氯气,防止污染空气,洗气装置导气管长进短处,导气管口连接顺序为:a e d b c f,故答案为:a e d b c f;
(2)气体中含有水蒸气,FeCl3容易水解,C装置中是浓硫酸作用是干燥氯气,故答案为:干燥氯气;
(3)氯气有毒不能排放到空气中,氢氧化钠作用是吸收尾气氯气,防止污染空气,故答案为:吸收尾气氯气;
(4)检验B装置中反应后铁是否有剩余的方法是,用磁铁吸引产物,若被磁铁吸引,则含有铁,
故答案为:用磁铁吸引产物,若被磁铁吸引,则含有铁;
(5)改用Fe和盐酸反应生成氯化亚铁,再通入过量氯气把氯化亚铁氧化为氯化铁,因为氯化铁水解,蒸干溶液,得到的是氢氧化铁;不能来制取无水氯化铁,
故答案为:否;由于FeCl3 水解,加热蒸干该溶液只能得到Fe(OH)3.
分析:(1)制备氯气中含有氯化氢和水蒸气,除去氯化氢气体用饱和食盐水,除去水蒸气用浓硫酸,应先除氯化氢,后干燥,最后吸收尾气中未反应的氯气,防止污染空气;
(2)如果进入B的气体不干燥,FeCl3容易水解;
(3)氯气有毒不能排放到空气中,需要进行尾气吸收;
(4)依据铁的特征性质,可以用磁铁进行检验;
(5)氯化亚铁可以被氧化为氯化铁,但氯化铁蒸干过程中促进氯化铁的水解,得到氢氧化铁,得不到氯化铁固体.
点评:本题考查了氯气制备的实验方法、注意问题、氯化铁的性质应用,本题有一定的综合性,把氯气的实验室制法和氯气的化学性质结合起来.考查学生对实验原理、实验装置的理解、物质的制备与性质,难度中等.
(2)气体中含有水蒸气,FeCl3容易水解,C装置中是浓硫酸作用是干燥氯气,故答案为:干燥氯气;
(3)氯气有毒不能排放到空气中,氢氧化钠作用是吸收尾气氯气,防止污染空气,故答案为:吸收尾气氯气;
(4)检验B装置中反应后铁是否有剩余的方法是,用磁铁吸引产物,若被磁铁吸引,则含有铁,
故答案为:用磁铁吸引产物,若被磁铁吸引,则含有铁;
(5)改用Fe和盐酸反应生成氯化亚铁,再通入过量氯气把氯化亚铁氧化为氯化铁,因为氯化铁水解,蒸干溶液,得到的是氢氧化铁;不能来制取无水氯化铁,
故答案为:否;由于FeCl3 水解,加热蒸干该溶液只能得到Fe(OH)3.
分析:(1)制备氯气中含有氯化氢和水蒸气,除去氯化氢气体用饱和食盐水,除去水蒸气用浓硫酸,应先除氯化氢,后干燥,最后吸收尾气中未反应的氯气,防止污染空气;
(2)如果进入B的气体不干燥,FeCl3容易水解;
(3)氯气有毒不能排放到空气中,需要进行尾气吸收;
(4)依据铁的特征性质,可以用磁铁进行检验;
(5)氯化亚铁可以被氧化为氯化铁,但氯化铁蒸干过程中促进氯化铁的水解,得到氢氧化铁,得不到氯化铁固体.
点评:本题考查了氯气制备的实验方法、注意问题、氯化铁的性质应用,本题有一定的综合性,把氯气的实验室制法和氯气的化学性质结合起来.考查学生对实验原理、实验装置的理解、物质的制备与性质,难度中等.

练习册系列答案
相关题目




 CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O