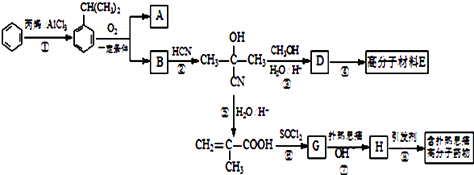
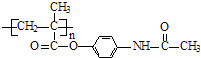
题目内容
【题目】配平下列化学方程式(其中(3)用双线桥标出转移的电子数
(1) Cu + HNO3(稀) — Cu(NO3)2 + NO↑ + H2O___________
(2) S+ NaOH— Na2S+ Na2SO3+ H2O_______________
(3) KClO3+ HCl— KCl+ Cl2↑+ H2O_____________
(4) Cr2O72-+ Fe2++ — Cr3++ Fe3++ ,_________________
【答案】 3 8 3 2 4 3 6 2 1 3  1 6 14H+ 2 6 7H2O
1 6 14H+ 2 6 7H2O
【解析】(1)该反应中Cu元素化合价由0价变为+2价、部分N元素化合价由+5价变为+2价,其得失电子最小公倍数是6,再通过观察配平得3Cu+8HNO3(稀)=3Cu(NO3)2 +2NO↑+4H2O,故答案为:3;8;3;2;4;
(2)硫元素化合价既升高又降低,降低2价,升高4价,得失电子应相等,所以转移电子数为4,所以方程式为:3S+6NaOH![]() 2Na2S+Na2SO3+3H2O,故答案为:3;6;2;1;3;
2Na2S+Na2SO3+3H2O,故答案为:3;6;2;1;3;
(3)氯酸钾中的氯元素化合价由+5降为0价,KClO3为氧化剂,盐酸中的氯元素由-1价升到0价,失去电子被氧化,则Cl2为氧化产物,由电子守恒及原子守恒可知,反应为KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,电子转移的方向和数目用双线桥表示为: ,故答案为:
,故答案为:  ;
;
(4)Cr2O72-中元素由+6价降低为+3价,化合价降低2×3=6,元素由+2价升高到+3价,化合价升高1,其得失电子最小公倍数是6,根据得失电子守恒,得Cr2O72-+6Fe2++____—2Cr3++6Fe3++___,根据电荷守恒和质量守恒知,反应物中需要提供H+,生成物中需要有H2O,通过观察,配平为Cr2O72-+6Fe2++14 H+=2Cr3++6Fe3++7H2O,故答案为:1;6;14H+;2;6;7H2O。

 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案