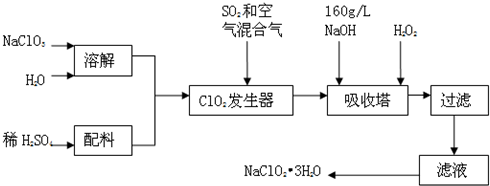
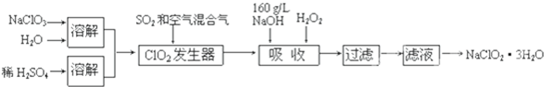
题目内容
(1)1L Na2SO4 溶液中,如果含钠元素的质量是2.3g,溶液中 SO42-物质的量浓度为______ mol/L.
(2)如果实验室没有 Na2SO4,可用 NaOH 和 H2SO4 反应配制 Na2SO4 溶液,从理论上计算,配制符合(1)的要求的 Na2SO4 溶液,需要NaOH的质量为______g 和 1.0mol/L硫酸溶液的体积为______ mL.(说明:按计算用量混合后,用蒸馏水稀释至1L 即可)
解:(1)钠离子的物质的量= ,则钠离子的物质的量浓度=
,则钠离子的物质的量浓度= ,硫酸钠溶液中钠离子浓度与氯酸根离子浓度之比是2:1,所以SO42-物质的量浓度=0.1mol/L×0.5=0.05mol/L,
,硫酸钠溶液中钠离子浓度与氯酸根离子浓度之比是2:1,所以SO42-物质的量浓度=0.1mol/L×0.5=0.05mol/L,
故答案为:0.05;
(2)根据钠离子守恒知,氢氧化钠的质量= ,
,
根据硫酸根离子守恒得,硫酸的物质的量= =0.05L=50mL,
=0.05L=50mL,
故答案为:4,50.
分析:(1)根据钠的质量计算钠的物质的量,根据C= 计算钠离子的物质的量浓度,硫酸钠溶液中钠离子浓度与氯酸根离子浓度之比是2:1;
计算钠离子的物质的量浓度,硫酸钠溶液中钠离子浓度与氯酸根离子浓度之比是2:1;
(2)根据钠原子守恒计算氢氧化钠的质量,根据硫酸根离子守恒计算硫酸的体积.
点评:本题考查了物质的量浓度的有关计算,明确物质间的关系是解本题关键,根据原子守恒来分析解答即可,难度不大.
 ,则钠离子的物质的量浓度=
,则钠离子的物质的量浓度= ,硫酸钠溶液中钠离子浓度与氯酸根离子浓度之比是2:1,所以SO42-物质的量浓度=0.1mol/L×0.5=0.05mol/L,
,硫酸钠溶液中钠离子浓度与氯酸根离子浓度之比是2:1,所以SO42-物质的量浓度=0.1mol/L×0.5=0.05mol/L,故答案为:0.05;
(2)根据钠离子守恒知,氢氧化钠的质量=
 ,
,根据硫酸根离子守恒得,硫酸的物质的量=
 =0.05L=50mL,
=0.05L=50mL,故答案为:4,50.
分析:(1)根据钠的质量计算钠的物质的量,根据C=
 计算钠离子的物质的量浓度,硫酸钠溶液中钠离子浓度与氯酸根离子浓度之比是2:1;
计算钠离子的物质的量浓度,硫酸钠溶液中钠离子浓度与氯酸根离子浓度之比是2:1;(2)根据钠原子守恒计算氢氧化钠的质量,根据硫酸根离子守恒计算硫酸的体积.
点评:本题考查了物质的量浓度的有关计算,明确物质间的关系是解本题关键,根据原子守恒来分析解答即可,难度不大.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
 HS-+OH-
HS-+OH-