题目内容
【题目】Ⅰ、已知下面在298K时的热化学方程式:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1,CH4(g)+2O2(g)=CO2(g)+2H2O (l) ΔH=-890.3 kJ·mol-1,C(s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1。根据上面的热化学方程式完成下列问题:
(1)通过计算说明等质量的H2、C、CH4完全燃烧时放出热量最多的是___。
(2)根据以上反应,则C(s)+2H2(g)=CH4(g)的焓变ΔH=___。
(3)已知H2O(l)=H2O(g) ΔH=+44.0kJ·mol-1
试写出甲烷燃烧生成二氧化碳和水蒸气的热化学方程式:___。
Ⅱ、为了解金属腐蚀的原因和寻求防止金属腐蚀的方法具有重要意义。
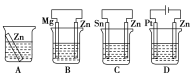
(1)分别放在以下装置(都盛有0.1mol·L-1的H2SO4溶液)中的四块相同的纯锌片,其中腐蚀最快的是___。
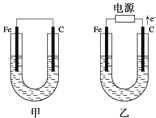
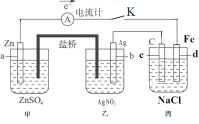
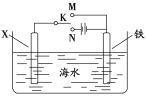
(2)利用如图装置,可以模拟铁的电化学防护。其中X为碳棒,为减缓铁的腐蚀,开关K应置于___处。若X为锌,开关K置于M处,该电化学防护法称为___。
【答案】H2 -74.8kJ·mol-1 CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-802.3 kJ·mol-1 C N 牺牲阳极保护法(或牺牲阳极的阴极保护法)
【解析】
根据热化学方程式的含义以及对应的反应热进行计算;
(2)根据盖斯定律来计算化学反应的焓变;
(3)根据盖斯定律来解答。
(1)设质量都为m,根据热化学方程式可知相同质量的H2、CH4、C完全燃烧时,放出热量分别是![]() 、
、![]() 、
、![]() 、最大值应为
、最大值应为![]() ,因此相同质量的H2、CH4、C完全燃烧时,放出热量最多的是H2;
,因此相同质量的H2、CH4、C完全燃烧时,放出热量最多的是H2;
(2)已知:
①2H2(g)+O2(g)=2H2O(l) ΔH= -571.6 kJ·mol-1
②CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH= -890.3 kJ·mol-1
③C(s)+O2(g)=CO2(g) ΔH= -393.5 kJ·mol-1
根据盖斯定律可知①+③-②得热化学方程式为
C(s)+2H2(g)=CH4(g)△H=-74.8 kJ·mol-1;
(3)已知:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH= -890.3 kJ·mol-1
②H2O(l)=H2O(g) ΔH= +44.0 kJ·mol-1
根据盖斯定律可知①+②×2即得到热化学方程式CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H= -802.3 kJ·mol-1;
Ⅱ(1)金属腐蚀快慢顺序是:电解池阳极>原电池负极>化学腐蚀>原电池正极>电解池阴极,根据图知,B中锌作正极、C中锌作负极、D中锌作阴极,所以锌被腐蚀快慢顺序是:C > A > B > D,则被腐蚀最快的是C,故C正确;
(2)作原电池正极或作电解池阴极的金属被保护,若X为碳棒,为减缓铁的腐蚀,则铁应作电解池阴极,所以开关K应该置于处N处;若X为锌,开关K置于M处,该装置构成原电池,锌易失电子作负极,铁作正极而被保护,该电化学防护法称为牺牲阳极的阴极保护法。

 阅读快车系列答案
阅读快车系列答案