题目内容
如图所示.实验时向
NaOH固体表面滴几滴浓氨水,立即用一个表面皿扣在上面.下列对实验现象所做的解释中正确的是________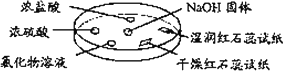
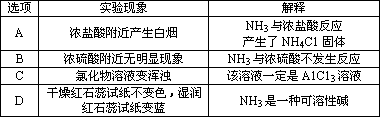
答案:A
解析:
解析:
|
A选项,浓盐酸具有挥发性,与产生的NH3反应生成NH4Cl固体而出现白烟.B选项,由于浓硫酸无挥发性,所以在浓硫酸周围看不到明显现象,但H2SO4能与NH3反应产生(NH4)2SO4.C选项,若溶液中含有Mg2+,溶液也会变混浊.D选项,NH3与H2O反应生成NH3·H2O,NH3不是碱. |

练习册系列答案
相关题目
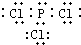

 合成氨工业对国民经济和社会发展具有重要的意义.其原理为:
合成氨工业对国民经济和社会发展具有重要的意义.其原理为: