题目内容
【题目】现往体积固定的密闭容器中通入等物质的量的NO2和CO,反应中的CO和NO的浓度随时间变化的示意图如图。根据图意回答下列问题:
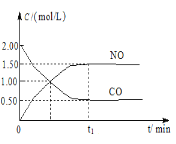
(1)从反应开始到平衡,用NO2浓度变化表示平均反应速率υ(NO2)=___。
(2)830K时,在密闭容器中发生下列可逆反应:CO(g)+H2O(g)![]() CO2(g)+H2(g)△H<0。试回答:
CO2(g)+H2(g)△H<0。试回答:
①若起始时c(CO)=2mol·L-1,c(H2O)=3mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K=____。
②在相同温度下,若起始时c(CO)=1mol·L-1,c(H2O)=2mol·L-1,反应进行一段时间后,测得H2的浓度为0.5mol·L-1,则此时该反应是否达到平衡状态___(填“是”与“否”),此时υ(正)__υ(逆)(填“大于”“小于”或“等于”)。
【答案】![]() 1 否 大于
1 否 大于
【解析】
(1)由图可知,t1min到达平衡,平衡时NO的浓度变化量为1.5mol/L,根据υ=![]() 计算υ(NO),再利用速率之比等于化学计量数之比计算υ(NO2);
计算υ(NO),再利用速率之比等于化学计量数之比计算υ(NO2);
(2)①根据三段式解题法,求出反应混合物各组分浓度的变化量、平衡时各组分的浓度,代入平衡常数表达式计算平衡常数;
②计算瞬时的浓度商Qc,与平衡常数比较判断反应进行方向,据此解答;
(1)由图可知,t1min到达平衡,平衡时NO的浓度变化量为1.5mol/L,故υ(NO)=![]() ,因化学反应速率之比等于化学计量数之比,故υ(NO2)=υ(NO)=
,因化学反应速率之比等于化学计量数之比,故υ(NO2)=υ(NO)=![]() ;故答案为:
;故答案为:![]() 。
。
(2)①若起始时c(CO)=2mol·L-1,c(H2O)=3mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,
CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
开始(mol/L):2 3 0 0
变化(mol/L):2×60% 1.2 1.2 1.2
平衡(mol/L):0.8 1.8 1.2 1.2
反应的平衡常数K=![]() =1;故答案为:1。
=1;故答案为:1。
②在相同温度下,若起始时c(CO)=1molL-1,c(H2O)=2molL-1,反应进行一段时间后,测得H2的浓度为0.5molL-1,则:
CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
开始(mol/L):1 2 0 0
变化(mol/L):0.5 0.5 0.5 0.5
末态(mol/L):0.5 1.5 0.5 0.5
浓度商Qc=![]() <1,故反应正向进行,此时υ(正)>υ(逆);
<1,故反应正向进行,此时υ(正)>υ(逆);
故答案为:否;大于。

 通城学典默写能手系列答案
通城学典默写能手系列答案【题目】实验室有一未知浓度的盐酸,某同学在实验室中进行实验测定盐酸的浓度。请完成下列填空:
配制100mL0.10molL-1NaOH标准溶液。取20.00mL待测盐酸放入锥形瓶中,滴加 2~3滴酚酞作指示剂,用配制的标准 NaOH溶液进行滴定。重复上述滴定操作 2~3次,记录数据如下:
滴定次数 | 待测盐酸的体积/mL | 0.10 mol/L NaOH 溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
第一次 | 20.00 | 2.00 | 28.15 |
第二次 | 20.00 | 1.50 | 29.50 |
第三次 | 20.00 | 0.20 | 26.55 |
①该实验滴定达到终点的标志是____
②根据上述数据,可计算出该盐酸的浓度约为___。(保留两位有效数字)
③在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有____。(双选)
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸润洗
C.锥形瓶水洗后未干燥
D.碱式滴定管尖嘴部分有气泡,滴定后消失
E.称量NaOH 固体时,混入少量KOH杂质
④现用以上实验配制的0.10molL-1NaOH溶液滴定未知浓度的CHCOOH溶液,反应恰好完全时,下列叙述中正确的是___
A.溶液呈中性,可选用甲基橙或酚酞作指示剂
B.溶液呈中性,只能选用石蕊作指示剂
C.溶液呈碱性,可选用甲基橙或酚酞作指示剂
D.溶液呈碱性,只能选用酚酞作指示剂