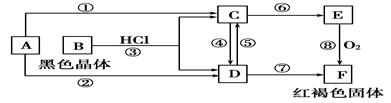
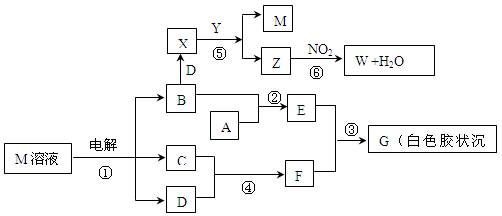
题目内容
14分)某合成氨厂利用附近化工厂副产品CaSO4设计了以下制备(NH4)2SO4的工艺流程:
请回答以下问题:
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式: 。
(2)工业上在500℃左右使用铁触媒作为催化剂合成NH3,
①铁触媒中含有Fe3+,,则Fe3+的核外电子排布式为
②500℃时,合成塔中的反应为:N2(g)+3H2(g)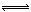 2NH3(g) ?H= -92.4kJ/mol在密闭条件下,下列示意图能说明反应进行到t1时刻时达到平衡状态的是 (填字母编号)。
2NH3(g) ?H= -92.4kJ/mol在密闭条件下,下列示意图能说明反应进行到t1时刻时达到平衡状态的是 (填字母编号)。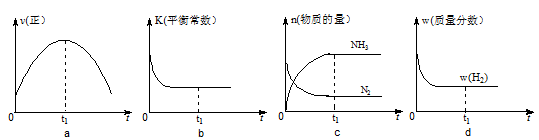
(3)沉淀池中反应的化学方程式为
(4)在上述流程中可以循环使用的X是 (填化学式),从(NH4)2SO4溶液中获得 (NH4)2SO4晶体操作的步骤是是加热浓缩、 、过滤、洗涤、干燥。
(14分)(1)2NH4HS+O2=2S+2NH3·H2O(3分)
(2)〔Ar〕3d5或1s22s22p63s23p63d5(2分) c d(2分)
(3)CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4(3分)
(4)CO2(2分) 冷却结晶(2分)。
解析试题分析:(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,则再生反应的化学方程式是:2NH4HS+O2=2S+2NH3·H2O;(2)①Fe是26号元素,Fe3+核外有23个电子,则Fe3+的核外电子排布式为〔Ar〕3d5或1s22s22p63s23p63d5;②当反应达到平衡状态时,各种物质的浓度不变,正反应和逆反应的速率保持不变,各种物质的含量保持不变。A温度越高,反应速率越快,因此不能说在t1时刻正反应和逆反应的速率最高,错误;b.化学平衡常数与温度有关,与该反应是否达到平衡无关,温度升高,平衡逆向移动,化学平衡常数减小,而图示的是不同温度,平衡常数相同,因此表示错误;c.在t1时刻,N2、H2的浓度都不随时间而改变,因此反应达到平衡,正确;d.该反应是反应前后气体体积不等的反应,由于氢气的含量不变,则总物质的量不变,氢气的物质的量不变,所以反应达到平衡,正确;选项是c、d;(3)在沉淀池中CaSO4、CO2、NH3反应形成CaCO3沉淀及(NH4)2SO4。反应的化学方程式为CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4;(4)产生的CaCO3沉淀过滤出来,高温煅烧可得CO2、CaO,载通入沉淀池中发生反应,因此在上述流程中可以循环使用的X是从(NH4)2SO4溶液中获得 (NH4)2SO4晶体操作的步骤是是加热浓缩、冷却结晶、过滤、洗涤、干燥。
考点:考查制备(NH4)2SO4的工艺流程的知识,包括原子的核外电子排布式和化学方程式的书写、化学平衡状态的判断、物质的循环利用、混合物的分离与提纯的知识。

下列反应中生成物总能量高于反应物总能量的是
| A.碳酸钙受热分解 | B.乙醇燃烧 |
| C.铝粉与氧化铁粉末反应 | D.氧化钙溶于水 |
未来新能源的特点是资源丰富,在使用时对环境无污染或很少污染,且有些可以再生。下列属于新能源的是( )
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥燃料电池 ⑦风能 ⑧氢能
| A.①②③④ | B.⑤⑥⑦⑧ | C.③④⑤⑥ | D.除①②外 |
下列属于分离、提纯固态有机物的操作的是( )
| A.蒸馏 | B.萃取 | C.重结晶 | D.分液 |
下列各组仪器:①漏斗②容量瓶③滴定管④分液漏斗⑤天平⑥量筒⑦胶头滴管⑧蒸馏烧瓶.常用于物质分离的是
| A.①③⑦ | B.②⑥⑦ | C.①④⑧ | D.④⑥⑧ |