题目内容
把0.1 mol MnO2粉末加入到50 mL过氧化氢的溶液里(密度为1.1 g·mL-1),在标准状况下,放出气体的体积V和时间t的关系曲线如图所示.
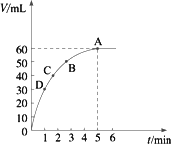
(1)实验时放出气体的总体积是________.
(2)放出一半气体所需的时间约为________.
(3)A、B、C、D各点反应速率快慢的顺序是________.
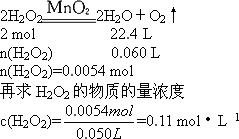
(4)过氧化氢溶液的初始物质的量浓度为________.
解析:
|
答案:(1)60 mL (2)1 min (3)D>C>B>A (4)0.11 mol·L-1 解析:(1)曲线水平时,对应V轴体积是60 mL,此即放出气体的总体积. (2)60 mL的一半是30 mL,30 mL对应的时间约是1 min. (3)开始时,反应物浓度大,反应速率快,故D点最快,A点最慢. (4)先求H2O2的物质的量 |

 阅读快车系列答案
阅读快车系列答案|
把3 mol P和2.5 mol Q置于2 L密闭容器中,发生如下反应:3P(g)+Q(g) | |
| [ ] | |
A. |
P的平均反应速率为0.15 mol/(L·min) |
B. |
Q的转化率为25% |
C. |
Q的平衡浓度为1 mol/L |
D. |
x是2 |
|
在一定温度下,把3.0 moL M和2.5 moL N混合于2.0 L的密闭容器中,发生反应的化学方程式为:3M(g)+N(g) | |
| [ ] | |
A. |
X的值为1 |
B. |
M的平均反应速率为0.15 mol·L-1·min-1 |
C. |
M的转化率为60% |
D. |
平衡时P的浓度为0.25 mol·L-1 |