题目内容
【题目】碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。请回答下列问题:
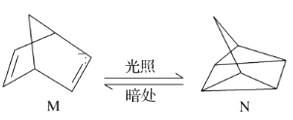
(1)有机物M经过太阳光光照可转化成N,转化过程如下,ΔH=+88.6 kJ·mol-1。则M、N相比,较稳定的是________。
(2)已知CH3OH(l)的燃烧热ΔH=-726.5 kJ·mol-1,CH3OH(l)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-a kJ·mol-1则a________726.5(填“>”“<”或“=”)
O2(g)=CO2(g)+2H2(g) ΔH=-a kJ·mol-1则a________726.5(填“>”“<”或“=”)
(3)将Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145.0 kJ热量,写出该反应的热化学方程式:________________________________________。
(4)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料:4Al(s)+3TiO2(s)+3C(s)===2Al2O3(s)+3TiC(s) ΔH=-1 176.0 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为_______。
(5) 已知:①C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1
②2CO(g)+O2(g)===2CO2(g) ΔH2=-566 kJ·mol-1
③TiO2(s)+2Cl2(g)===TiCl4(s)+O2(g) ΔH3=+141 kJ·mol-1
则TiO2(s)+2Cl2(g)+2C(s)===TiCl4(s)+2CO(g)的 ΔH=__________________。
(6)已知拆开1 mol H—H键,1 mol N—H键,1mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2(g)与H2(g)反应生成NH3(g)的热化学方程式为:________________。
【答案】M < 2Cl2(g)+2H2O(g)+C(s)=4HCl(g)+CO2(g) ΔH=-290.0 kJ·mol-1 98.0 kJ —80 kJ·mol-1 N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.0 kJ·mol-1
2NH3(g) ΔH=-92.0 kJ·mol-1
【解析】
(1)M转化为N是吸热反应,所以N的能量高,不稳定;
(2)甲醇燃烧生成CO2(g)和H2(g)属于不完全燃烧,放出的热量少,故a<238.6;
(3)有1mol Cl2参与反应时释放出145kJ热量,2mol氯气反应放热290kJ,注物质聚集状态和对应反应焓变写出热化学方程式;
(4)所给反应中转移12个电子,故每转移1mol电子放出的热量为![]() =98kJ;
=98kJ;
(5)先根据反应物和生成物书写化学方程式,根据盖斯定律计算反应的焓变,最后根据热化学方程式的书写方法来书写热化学方程式;
(6)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热。
(1)有机物M经过太阳光光照可转化为N的关系是吸收能量,则N能量高,比M活泼,较稳定的化合物为M;
(2)甲醇燃烧生成CO2(g)和H2(g)属于不完全燃烧,放出的热量少,所以a<726.5,故答案为:<;
(3)有1mol Cl2参与反应时释放出145kJ热量,2mol氯气反应放热290kJ,反应的热化学方程式为:2Cl2(g)+2H2O(g)+C(s)═4HCl(g)+CO2(g)△H=-290kJmol-1 ;
(4)4Al(s)+3TiO2(s)+3C(s)═2Al2O3(s)+3TiC(s)△H=-1176kJmol-1,转移12mol电子放热1176kJ,则反应过程中,每转移1mol电子放热98.0 kJ;
(5)已知:①C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH2=-566 kJ·mol-1
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) ΔH3=+141 kJ·mol-1
根据盖斯定律,由①![]() 2-②+③得反应TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的 ΔH=ΔH1
2-②+③得反应TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的 ΔH=ΔH1![]() 2-ΔH2+ΔH3=—80 kJ·mol-1;
2-ΔH2+ΔH3=—80 kJ·mol-1;
(6)在反应N2+3H22NH3中,断裂3molH-H键,1mol N三N键共吸收的能量为:3×436kJ+946kJ=2254kJ,生成2mol NH3,共形成6mol N-H键,放出的能量为:6×391kJ=2346kJ,吸收的热量少,放出的热量多,该反应为放热反应,放出的热量为:2346kJ-2254kJ=92kJ,则N2(g)与H2(g)反应生成NH3(g)的热化学方程式为: N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.0 kJ·mol-1。
2NH3(g) ΔH=-92.0 kJ·mol-1。

 轻松暑假总复习系列答案
轻松暑假总复习系列答案