题目内容
【题目】下面是同学们熟悉的物质:
①![]() ;
;![]() ;
;![]() ;
;![]() ;
;![]() ;
;![]() ;
;![]() ;
;![]() ;
;![]() ;⑩NaOH
;⑩NaOH
(1)这些物质中,属于共价化合物的是______![]() 填序号,下同
填序号,下同![]() ;只含有离子键的是______;不含化学键的是______。
;只含有离子键的是______;不含化学键的是______。
(2)写出下列物质的结构式![]() ______;
______;![]() ______。
______。
(3)写出下列物质的电子式![]() ______;⑩NaOH______。
______;⑩NaOH______。
【答案】②④⑦ ③ ⑧ ![]()
![]()
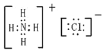
![]()
【解析】
![]() 一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,由单原子分子形成的物质不含化学键;只含共价键的化合物为共价化合物,含有离子键的化合物为离子化合物,当然注意个别特例;
一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,由单原子分子形成的物质不含化学键;只含共价键的化合物为共价化合物,含有离子键的化合物为离子化合物,当然注意个别特例;
![]() 过氧化氢、二氧化碳均通过共价键而使分子内的原子达到了稳定结构,据此可写结构式;
过氧化氢、二氧化碳均通过共价键而使分子内的原子达到了稳定结构,据此可写结构式;
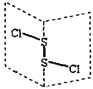
![]() 氯化铵为离子晶体,由铵根离子与氯离子通过离子键结合在一起;氢氧化钠中钠离子与氢氧根离子通过离子键结合,氢氧根内部氧与氢原子共用1对电子;
氯化铵为离子晶体,由铵根离子与氯离子通过离子键结合在一起;氢氧化钠中钠离子与氢氧根离子通过离子键结合,氢氧根内部氧与氢原子共用1对电子;
![]() ①O2是单质,含有共价键;
①O2是单质,含有共价键;![]() 是化合物,只含共价键,为共价化合物;③MgCl2只含离子键,是离子化合物;④H2SO4是化合物,只含共价键,是共价化合物;
是化合物,只含共价键,为共价化合物;③MgCl2只含离子键,是离子化合物;④H2SO4是化合物,只含共价键,是共价化合物;![]() 是化合物,既含有共价键又含有离子键,是离子化合物;
是化合物,既含有共价键又含有离子键,是离子化合物;![]() 是化合物,既含有共价键又含有离子键,是离子化合物;
是化合物,既含有共价键又含有离子键,是离子化合物;![]() 是化合物,只含共价键,是共价化合物;⑧Ne为单原子分子,不含化学键;
是化合物,只含共价键,是共价化合物;⑧Ne为单原子分子,不含化学键;![]() 是化合物,既含有共价键又含有离子键,是离子化合物;⑩NaOH化合物,既含有共价键又含有离子键,是离子化合物;
是化合物,既含有共价键又含有离子键,是离子化合物;⑩NaOH化合物,既含有共价键又含有离子键,是离子化合物;
所以:属于共价化合物的是②④⑦;只含有离子键的是③;不含化学键的是⑧;
故答案为:②④⑦;③;⑧;
![]() 过氧化氢存在
过氧化氢存在![]() 和
和![]() 共价键,结构式为:
共价键,结构式为:![]() ,二氧化碳含有2个
,二氧化碳含有2个![]() 共价键,结构式为:
共价键,结构式为:![]() ;
;
故答案为:![]() ;
;![]() ;
;
![]() 氯化铵为离子晶体,其电子式为:
氯化铵为离子晶体,其电子式为: ;氢氧化钠电子式为:
;氢氧化钠电子式为: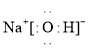 ;
;
故答案为: ;
;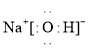 。
。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案【题目】某兴趣小组用粗CuO(仅含杂质FeO)制备氯化铜晶体(CuCl2·2H2O)并进一步测定纯度,具体流程如下:

相关信息如下:
①氯化铜从水溶液中结晶时,在15℃以下得到四水物,在15~25.7℃得到三水物,在26~42℃得到二水物,在42℃以上得到一水物,在100℃得到无水物。
②金属离子形成氢氧化物沉淀的pH范围。
金属离子 | pH | |
开始沉淀 | 完全沉淀 | |
Fe3+ | 1.5 | 2.8 |
Fe2+ | 5.5 | 8.3 |
Cu2+ | 5.2 | 6.4 |
(1)步骤II加入稍过量的双氧水的目的是___。
(2)步骤III,需要用到下列所有的操作:
a.用盐酸溶解 b.调pH=3.0 c.调pH=7.0 d.洗涤 e.过滤。
请给出上述操作的正确顺序________(操作可重复使用)。
(3)步骤IV的装置图如图:
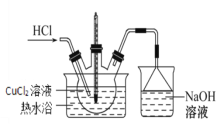
①持续通入HCl的作用是________。
②加热蒸发浓缩,当溶液体积减少到原来的![]() 时,调整水浴温度控制在_______时析出晶体,抽滤,洗涤,干燥。
时,调整水浴温度控制在_______时析出晶体,抽滤,洗涤,干燥。
③关于上述操作的说法不合理的是________。
A.抽滤时,需用玻璃纤维替代滤纸
B.洗涤晶体时应先关闭水龙头,再加入洗涤剂
C.抽滤完毕时,断开水泵和吸滤瓶之间的橡胶管,再关闭水龙头
D.为得到纯净的CuCl2·2H2O晶体宜采用低温干燥
(4)用“间接碘量法”测定CuCl2·2H2O样品的纯度,过程如下:取0.4000g试样溶于水,加入过量KI固体,充分反应,生成白色CuI沉淀,滴入几滴淀粉溶液作指示剂,用0.1000mol·L-1Na2S2O3 标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL。(滴定反应为I2+2S2O32-=S4O62-+2I-)
①写出生成白色CuI沉淀的离子方程式________。
②该样品中CuCl2·2H2O的质量分数为________。