题目内容
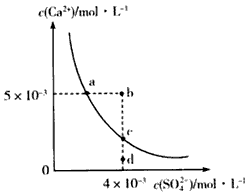
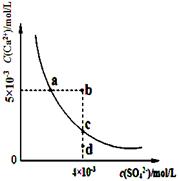
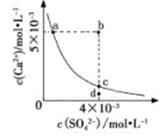
 常温下,CaSO4在水中的沉淀溶解平衡曲线如图所示,已知Ksp(CaSO4)=9×10-6.下列说法正确的是( )
常温下,CaSO4在水中的沉淀溶解平衡曲线如图所示,已知Ksp(CaSO4)=9×10-6.下列说法正确的是( )| A、a点对应的Ksp小于c点对应的Ksp | B、a点变为b点将有沉淀生成 | C、加入蒸馏水可以使c点变为d点 | D、含有大量SO42-的溶液中肯定不存在Ca2+催化剂 |
分析:该图中的是平衡曲线,线上的任意点都是平衡状态,b和d不在曲线上不是平衡状态,
A.Ksp与温度有关,a和c的Ksp相等;
B.b点Qc>Ksp;
C.加入蒸馏水离子浓度都减小,c点不可能到d点;
D.含有大量SO42-的溶液中也存在Ca2+.
A.Ksp与温度有关,a和c的Ksp相等;
B.b点Qc>Ksp;
C.加入蒸馏水离子浓度都减小,c点不可能到d点;
D.含有大量SO42-的溶液中也存在Ca2+.
解答:解:该图中的是平衡曲线,线上的任意点都是平衡状态,b和d不在曲线上不是平衡状态,
A.Ksp是一常数,温度不变Ksp不变,在曲线上的任意一点Ksp都相等,故A错误;
B.据图示数据,可以看出b点Qc=2×l0-5>Ksp,所以会生成沉淀,因此a点变为b点将有沉淀生成,故B正确;
C.加入蒸馏水离子浓度都减小,而c点到d点硫酸根离子浓度不变,所以加水c点不可能到d点,故C错误;
D.含有大量SO42-的溶液中c(SO42ˉ)较大,由于c(SO42-)?c(Ca2+)=Ksp,所以Ca2+的浓度不为零,所以含有大量SO42-的溶液中也存在Ca2+,故D错误;
故选:B.
A.Ksp是一常数,温度不变Ksp不变,在曲线上的任意一点Ksp都相等,故A错误;
B.据图示数据,可以看出b点Qc=2×l0-5>Ksp,所以会生成沉淀,因此a点变为b点将有沉淀生成,故B正确;
C.加入蒸馏水离子浓度都减小,而c点到d点硫酸根离子浓度不变,所以加水c点不可能到d点,故C错误;
D.含有大量SO42-的溶液中c(SO42ˉ)较大,由于c(SO42-)?c(Ca2+)=Ksp,所以Ca2+的浓度不为零,所以含有大量SO42-的溶液中也存在Ca2+,故D错误;
故选:B.
点评:本题考查了沉淀溶解平衡的应用,图象分析应用,溶度积计算分析,平衡移动方向的判断,关键是计算混合溶液中钙离子浓度和硫酸根离子浓度,题目难度中等.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
 (2011?沈阳二模)常温下,CaSO4在水中的沉淀溶解平衡曲线如图所示,Ksp(CaSO4)=9?10-6.下列说法中正确的是( )
(2011?沈阳二模)常温下,CaSO4在水中的沉淀溶解平衡曲线如图所示,Ksp(CaSO4)=9?10-6.下列说法中正确的是( )