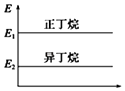
��Ŀ����
����Ŀ��Ϊ�˽�����Na2SO4��NaHCO3��NaCl�����ᴿ���Ƶô������Ȼ�����Һ��ijѧ���������ͼ��ʾ��ʵ�鷽����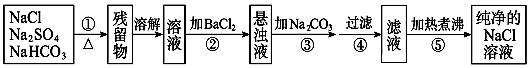
��֪̼�������ڼ����������ֽܷ��̼���ơ�������̼��ˮ����NaCl��Na2SO4�������ʱ��������ѧ�仯����ش��������⣺
��1��������ʢ��ҩƷ��ѡ�������������ƣ���
��2��������Ϊʲô����Ba��NO3��2��Һ���������ǣ� ��
��3�����в����ں��ж�SO42���ѳ����ķ����ǣ� ��
��4�������۵�Ŀ���ǣ� ��
��5������Ʒ����Ƿ���������ǡ������� ��
���𰸡�
��1������
��2��ʹ��Ba��NO3��2��Һ,���������ȥ����������NO3��
��3���ڵμ�BaCl2��Һ�Ĺ�����,����,ȡ�ϲ���Һ���Թ���,�ȼ�����������������,�ټ��뼸��BaCl2,����������,��֤��SO42���ѳ���
��4����ȥ������Ba2+
��5����,���Ȳ��ܳ�ȥ������Na2CO3,Ӧ�ڢܺ���������������ȥNa2CO3,�ټ�����г�ȥ����������
���������⣺��1�����������ڼ��ȹ��壬Ӧ�������н��С�
���Դ��ǣ�������
��2�������Ȼ���������̼�ᱵ�����ᱵ���Ȼ��ƣ���������ᱵ���ɻ�����NO3�����ʡ�
���Դ��ǣ�ʹ��Ba��NO3��2��Һ�����������ȥ����������NO3����
��3���ж������Ƿ���������øɾ����Թ�ȡ�ϲ���Һ�����Թ��еμ�BaCl2��Һ��������˵��SO42���ѳ�������������Ϊ�ڵμ�BaCl2��Һ�Ĺ����У����ã�ȡ�ϲ���Һ���Թ��У��ȼ������������������ټ��뼸��BaCl2�����������ɣ���֤��SO42���ѳ�����
���Դ��ǣ��ڵμ�BaCl2��Һ�Ĺ����У����ã�ȡ�ϲ���Һ���Թ��У��ȼ������������������ټ��뼸��BaCl2�����������ɣ���֤��SO42���ѳ�����
��4�������������Ȼ����������̼���ƣ��Գ�������Ba2+��
���Դ��ǣ���ȥ������Ba2+��
��5��ʵ�鲻���ܣ���Һ�е���Ҫ�ɷ�Ϊ�Ȼ��ƺ�̼���ƣ���õ��������Ȼ��ƣ�Ӧ�ȼ������ᣬ�ټ�����У�
���Դ��ǣ����Ȳ��ܳ�ȥ������Na2CO3��Ӧ�ڢܺ���������������ȥNa2CO3���ټ�����г�ȥ���������ᣮ

 ��ְٷְټ�����Ԫ��ĩ���Ծ�ϵ�д�
��ְٷְټ�����Ԫ��ĩ���Ծ�ϵ�д� Сѧ��ĩ���Ծ�ϵ�д�
Сѧ��ĩ���Ծ�ϵ�д�����Ŀ����ҵ��һ���ں����ܱ������п��Բ������з�Ӧ�ϳɼ״���CO��g��+2H2��g��CH3OH��g��
��1���жϷ�Ӧ�ﵽƽ��״̬�������ǣ�����ĸ��ţ���ͬ�� ��
A.����CH3OH������������CO���������
B.���������ܶȲ���
C.��������ƽ����Է�����������
D.CH3OH��CO��H2��Ũ�ȶ����ٷ����仯
E.�����������ѹǿ���ٸı�
��2�������������Ƿ�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ����K����
�¶� | 250�� | 300�� | 350�� |
K | 2.041 | 0.270 | 0.012 |
��д���÷�Ӧ��ƽ�ⳣ��K�ı���ʽ
���ɱ��������жϸ÷�Ӧ�ġ�H0�����������=����������
��ij�¶��£���2mol CO��6mol H2����2L���ܱ������У�5minʱ�ﵽƽ�⣬���c��CO��=0.2mol/L����CO��ת����Ϊ �� ��ʱ���¶�Ϊ �� ��0��5min�ڣ���H2��ʾ��ƽ����Ӧ����ΪmolL��1min��1 �� ƽ��ʱCH3OH��Ũ��ΪmolL��1
����Ŀ��CO�ǻ������糧�ͷų�����Ҫβ����Ϊ���ٶԻ�����Ⱦ�����糧��ͼ����CO��Cl2�ڴ����������ºϳɹ�����COCl2����ij�¶��£���2L���ܱ�������Ͷ��һ������CO��Cl2 �� �ڴ����������·�����Ӧ��CO��g��+Cl2��g��COCl2��g����H=a kJ/mol
��Ӧ�����вⶨ�IJ������������
t/min | n ��CO��/mol | n ��Cl2��/mol |
0 | 1.20 | 0.60 |
1 | 0.90 | |
2 | 0.80 | |
4 | 0.20 |
��1���Ƚϸ�ʱ��ƽ������v��COCl2����v��0��1��v��0��2����v��0��2��v��1��2�� �����������=����������
��2����2min��4min�䣬v��Cl2����v��Cl2���� �����������=�������������¶���K=
��3����֪X��L�ɷֱ�����¶Ȼ�ѹǿ����ͼ��ʾLһ��ʱ��CO��ש������X�ı仯��ϵ��
X����������������a0 �����������=��������������������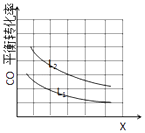
����Ŀ���������ȣ�ClNO�����л��ϳ��е���Ҫ�Լ����������ȿ���NO��Cl2��ͨ�������·�Ӧ�õ�����ѧ����ʽΪ2NO��g��+Cl2��g��2ClNO��g����
��1�����������������ڴ����еĺ������������ʱ�������������ȣ��漰���·�Ӧ��
��4NO2��g��+2NaCl��s��2NaNO3��s��+2NO��g��+Cl2��g�� K1
��2NO2��g��+NaCl��s��NaNO3��s��+ClNO��g�� K2
��2NO��g��+Cl2��g��2ClNO��g�� K3
��K1 �� K2 �� K3֮��Ĺ�ϵΪK3= ��
��2��T��ʱ��2NO��g��+Cl2��g��2ClNO��g��������Ӧ���ʱ���ʽΪv��=k cn��ClNO����������ʺ�Ũ�ȵĹ�ϵ�����
��� | c��ClNO��/molL��1 | v/molL��1s��1 |
�� | 0.30 | 3.6��10��8 |
�� | 0.60 | 1.44��10��7 |
�� | 0.90 | 3.24��10��7 |
n=��k=��ע����λ����
��3����2L�ĺ����ܱ������г���4molNO��g����2molCl2��g�����ڲ�ͬ�¶��²��c��ClNO����ʱ��Ĺ�ϵ��ͼA�� 
���¶�ΪT1ʱ������Ϊ�÷�Ӧ�ﵽƽ��ı�־������
a������������ֲ��� b������ѹǿ���ֲ��� c��ƽ�ⳣ��K���ֲ���
d��������ɫ���ֲ��� e��v��ClNO��=v��NO�� f��NO�� ClNO�����ʵ�����ֵ���ֲ���
�ڷ�Ӧ��ʼ��10minʱCl2��ƽ����Ӧ����v��Cl2��=��
���¶�ΪT2ʱ��10min�Ѿ��ﵽƽ�⣬�÷�Ӧ��ƽ�ⳣ��K=��ע����λ����
��4��һ���������ں��º��ݵ��ܱ������а�һ����������NO��g����Cl2��g����ƽ��ʱClNO������������� ![]() �ı仯ͼ����ͼB����A��B��C��״̬�У�NO��ת������С�����㣬��n��NO��/n��Cl2��=2.8ʱ���ﵽƽ��״̬ClNO����������տ�����D��E��F�����е��㣮
�ı仯ͼ����ͼB����A��B��C��״̬�У�NO��ת������С�����㣬��n��NO��/n��Cl2��=2.8ʱ���ﵽƽ��״̬ClNO����������տ�����D��E��F�����е��㣮