题目内容
11.在100℃时将甲醇、甲烷、氧气的混合气体充入装有过量Na2O2固体的密闭容器中,不断用电火花引燃,充分反应后,测得密闭容器内气体压强为零,则原混合气体中甲醇、甲烷、氧气的体积比可能是( )| A. | 1:1:1 | B. | 2:2:1 | C. | 1:3:2 | D. | 无法计算 |
分析 将含有甲醇、O2和CH4的混合气体置于盛有过量Na2O2的密闭容器中,电火花点燃反应为,2CH4O+3O2$\stackrel{点燃}{→}$2CO2+4H2O、CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O、2CO2+2Na2O2=2Na2CO3+O2、2H2O+2Na2O2=4NaOH+O2;
根据题意可知反应结束后,容器内的压强为零(100℃),说明恰好反应生成Na2CO3、NaOH,反应后容器中无气体剩余,结合反应2CH4+O2+6Na2O2=2Na2CO3+8NaOH、2CH4O+6Na2O2=2Na2CO3+8NaOH进行判断,以此解答该题.
解答 解:在100℃时,将甲醇.甲烷.氧气的混合气体放入一装有过量Na2O2固体的密闭容器中,不断用电火花引燃,充分反应后,测得密闭容器内气体压强为零,则反应后无气体剩余,反应后产物为Na2CO3、NaOH,
根据反应2CH4O+3O2$\stackrel{点燃}{→}$2CO2+4H2O、CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O、2CO2+2Na2O2=2Na2CO3+O2、2H2O+2Na2O2=4NaOH+O2可知总反应为:2CH4+O2+6Na2O2=2Na2CO3+8NaOH、2CH4O+6Na2O2=2Na2CO3+8NaOH,
则甲醇的物质的量多少不影响结果,关键满足甲烷与氧气的物质的量之比满足2:1即可,
选项中只有B符合,
故选B.
点评 本题考查了混合物反应的计算,为高频考点,题目难度中等,明确反应后产物组成为解答关键,注意掌握过氧化钠与水、二氧化碳反应的特点,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
8.某芳香族化合物的分子式为C7H6Cl2,该有机物的可能结构有(不考虑立体异构)( )
| A. | 9种 | B. | 10种 | C. | 11种 | D. | 12种 |
2.拟除虫菊酯是一类高效、低毒、对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图:
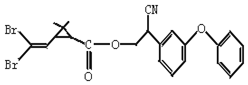
下列对该化合物叙述正确的是( )

下列对该化合物叙述正确的是( )
| A. | 属于芳香烃 | B. | 属于卤代烃 | ||
| C. | 有两种含氧官能团 | D. | 含苯环不含碳碳双键 |
19.下列事故处理不正确的是( )
| A. | 不慎碰倒酒精灯,洒出酒精在桌上燃烧,应立即用湿抹布扑盖 | |
| B. | 将一氧化碳中毒者移到通风处抢救 | |
| C. | 实验后,剩余的药品不能放回原瓶,也不能随便丢弃 | |
| D. | 不慎把浓碱溅在皮肤上,用大量水冲洗后,再涂上碳酸氢钠溶液 |
16.工业上冶炼钛有如右反应:TiCl4+2Mg $\frac{\underline{\;高温\;}}{\;}$ Ti+2MgCl2该反应属于( )
| A. | 化合反应 | B. | 分解反应 | C. | 置换反应 | D. | 复分解反应 |
3.某固体A在一定条件下加热分解,产物全是气体.A的分解反应为:2A$\frac{\underline{\;\;△\;\;}}{\;}$B+2C+2D,现测得分解产生的混合气体的密度是氢气的d倍,则A的相对分子量为( )
| A. | 2d | B. | 2.5d | C. | 5d | D. | 0.8d |
20.在温度T1和T2时,分别将1.00 mol CH4和2.40 mol NO2充入体积为1L的密闭容器发生如下反应:CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g),测得n(CH4)随时间变化数据如下表:下列说法不正确的是( )
| 时间/min | 0 | 10 | 20 | 40 | 50 | |
| T1 | n(CH4)/mol | 1.00 | 0.70 | 0.50 | 0.20 | 0.20 |
| T2 | n(CH4)/mol | 1.00 | 0.60 | 0.36 | … | 0.30 |
| A. | T2时NO2的平衡转化率为70.0% | |
| B. | 该反应的△H<0、T1<T2 | |
| C. | 保持其他条件不变,T1时向平衡体系中再充入1.00molCH4和2.40molNO2,与原平衡相比,达新平衡时N2的浓度增大、体积分数减小 | |
| D. | 保持其他条件不变,T1时向平衡体系中再充入0.60molCH4和1.60molH2O(g),平衡向正反应方向移动 |