��Ŀ����
����Ŀ���軯�ƣ�NaCN����һ����Ҫ����ԭ�ϣ����ڻ�ѧ�ϳɡ���ơ�ұ��ȷ��森NaCN�о綾�������ˮ�辭�������������ŷţ�ij��Ƴ������ˮ��һ�ֹ�ҵ�����������£� 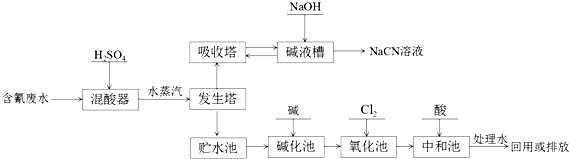 ��֪��HCNO�Ľṹʽ�ǣ�H��O��C��N
��֪��HCNO�Ľṹʽ�ǣ�H��O��C��N
HCN��Ka=6.02��10��10
[Ag��CN��2]����aq��Ag+��aq��+2CN����aq�� K=1.3��10��21
�ش��������⣺
��1��CN������ԭ�Ӿ�Ϊ8�����ȶ��ṹ����д��CN���ĵ���ʽ ��
��2���軯����ˮ������綾�����ᣬ��д����Ӧ�����ӷ���ʽ ��
��3����������ͨˮ������Ŀ���� ��
��4�����������軯��Ľ������������ CN�������������ɵͶ���CNO�� �� д����Ӧ�����ӷ���ʽ ��
CNO�������������������������壬д����Ӧ�����ӷ���ʽ
��5����ˮ���з�ˮ���Ⱦ�����ٽ���������ԭ��
��6����Ƴ������ʱ��Ҫ���ͶƲ�����ij����ٶȣ�ʹ�Ʋ�������ܣ����Һʹ��Na[Ag��CN��2]����д��������Ӧʽ �� ����ҵ�����ʹ�������ӣ�CN������ԭ�� ��
���𰸡�
��1��![]()
��2��CN��+H2OHCN+OH��
��3����ʹHCN�ӷ�����������
��4��CN��+Cl2+2OH��=CNO��+2Cl��+H2O��2CNO��+3Cl2+4OH��=N2��+CO2��+6Cl��+2H2O
��5����ֹ����HCN
��6��[Ag��CN��2]��+e��=Ag+2CN����Ag+��CN�����Խ�ϳ��ȶ����������Կ���������Ũ�ȣ�ʹ�Ʋ�����
���������⣺��1��CN���и�ԭ�Ӿ�����8�����ȶ��ṹ������C��N��������ʽΪ ![]() ���ʴ�Ϊ��
���ʴ�Ϊ�� ![]() ����2���軯������ˮ������軯�⣬����ʽΪCN��+H2OHCN+OH�� �� �ʴ�Ϊ��CN��+H2OHCN+OH������3����������ͨˮ������Ŀ���Ǵ�ʹHCN�ӷ��������������ʴ�Ϊ����ʹHCN�ӷ���������������4��CN�������������ɵͶ���CNO�� �� ͬʱ�õ���ԭ���������ӣ���CN��+Cl2+2OH��=CNO��+2Cl��+H2O��CNO���������������������������ǵ����Ͷ�����̼����2CNO��+3Cl2+4OH��=N2��+CO2��+6Cl��+2H2O�� �ʴ�Ϊ��CN��+Cl2+2OH��=CNO��+2Cl��+H2O��2CNO��+3Cl2+4OH��=N2��+CO2��+6Cl��+2H2O����5����ˮ���з�ˮ���Ⱦ�����ٽ����������������Է�ֹ����HCN���ʴ�Ϊ����ֹ����HCN����6�������У����Һʹ��Na[Ag��CN��2]���������Ϸ����õ��ӵĻ�ԭ��Ӧ������[Ag��CN��2]��+e��=Ag+2CN�� �� ��ҵ�����ʹ�������ӣ�����Ag+��CN�����Խ�ϳ��ȶ����������Կ���������Ũ�ȣ�ʹ�Ʋ����ܣ��ʴ�Ϊ��[Ag��CN��2]��+e��=Ag+2CN����Ag+��CN�����Խ�ϳ��ȶ����������Կ���������Ũ�ȣ�ʹ�Ʋ����ܣ�
����2���軯������ˮ������軯�⣬����ʽΪCN��+H2OHCN+OH�� �� �ʴ�Ϊ��CN��+H2OHCN+OH������3����������ͨˮ������Ŀ���Ǵ�ʹHCN�ӷ��������������ʴ�Ϊ����ʹHCN�ӷ���������������4��CN�������������ɵͶ���CNO�� �� ͬʱ�õ���ԭ���������ӣ���CN��+Cl2+2OH��=CNO��+2Cl��+H2O��CNO���������������������������ǵ����Ͷ�����̼����2CNO��+3Cl2+4OH��=N2��+CO2��+6Cl��+2H2O�� �ʴ�Ϊ��CN��+Cl2+2OH��=CNO��+2Cl��+H2O��2CNO��+3Cl2+4OH��=N2��+CO2��+6Cl��+2H2O����5����ˮ���з�ˮ���Ⱦ�����ٽ����������������Է�ֹ����HCN���ʴ�Ϊ����ֹ����HCN����6�������У����Һʹ��Na[Ag��CN��2]���������Ϸ����õ��ӵĻ�ԭ��Ӧ������[Ag��CN��2]��+e��=Ag+2CN�� �� ��ҵ�����ʹ�������ӣ�����Ag+��CN�����Խ�ϳ��ȶ����������Կ���������Ũ�ȣ�ʹ�Ʋ����ܣ��ʴ�Ϊ��[Ag��CN��2]��+e��=Ag+2CN����Ag+��CN�����Խ�ϳ��ȶ����������Կ���������Ũ�ȣ�ʹ�Ʋ����ܣ�
�����ˮ����ϡ�����ڻ������з�Ӧ�õ����ᣬͨ��ˮ�����ڷ������д�ʹHCN�ӷ�������������������������Һ���յõ�NaCN��Һ����������ʣ���ˮ�Ⱦ�����ٽ���������CN�������������ɵͶ���CNO�� �� CNO�������������������������嵪���Ͷ�����̼��Ȼ�����������к��˵ļ����ڣ�����ˮ���û��ŷţ���1��NaCNΪ���ӻ����CN���и�ԭ�Ӿ�����8�����ȶ��ṹ������C��N������2���軯������ˮ������軯�⣻��3����������ͨˮ�������Խ����ﴵ������4��CN�������������ɵͶ���CNO�� �� ͬʱ�õ���ԭ���������ӣ�CNO���������������������������ǵ����Ͷ�����̼���ݴ���д����ʽ����5�������������ᣬ���Ժͼ�֮�䷢����Ӧ����6�����ص������Ϸ����õ��ӵĻ�ԭ��Ӧ������Ag+��CN�����Խ�ϳ��ȶ�����������ش�

 Сѧѧϰ�ð���ϵ�д�
Сѧѧϰ�ð���ϵ�д� Сѧͬ�����������ܾ�ϵ�д�
Сѧͬ�����������ܾ�ϵ�д�