题目内容
 化学反应N2+3H2?2NH3的能量变化如图所示:
化学反应N2+3H2?2NH3的能量变化如图所示:(1)该反应为
(2)2mol氨汽化时
(3)由图可知,下列说法正确的是
A.a kJ表示断裂1mol N2和3mol H2中化学键所吸收的总能量.
B.bKJ表示形成2mol NH3中化学键所释放的能量
C.生成1mol NH3(g)所放出的能量可以用(b-a)KJ表示.
D.该反应化学键断裂所吸收的能量小于化学键形成所释放的能量.
考点:反应热和焓变
专题:化学反应中的能量变化
分析:根据反应热等于反应物总能量减去生成物总能量计算反应热并书写热化学方程式,注意反应物的物质的量和生成物的聚集状态,由图可以看出,0.5molN2(g)和1.5molH2(g)的化学键断裂需要吸收能量akJ,形成1molNH3(g)释放的能量为bkJ,
所以0.5N2(g)+1.5H2(g)=NH3(g)△H=(a-b)kJ/mol,
而1mol的NH3(g)转化为1mol的NH3(l)放出的热量为ckJ,
所以有:0.5N2(g)+1.5H2(g)=NH3(l)△H=(a-b-c)kJ/mol,
即:N2(g)+3H2(g)=2NH3(1)△H=2(a-b-c)kJ?mol-1.
所以0.5N2(g)+1.5H2(g)=NH3(g)△H=(a-b)kJ/mol,
而1mol的NH3(g)转化为1mol的NH3(l)放出的热量为ckJ,
所以有:0.5N2(g)+1.5H2(g)=NH3(l)△H=(a-b-c)kJ/mol,
即:N2(g)+3H2(g)=2NH3(1)△H=2(a-b-c)kJ?mol-1.
解答:
解:(1)由图可以看出,1molN和3molH的总能量大于1mol NH3(g)的能量,则生成NH3(g)的过程为释放能量的过程,故答案为:放;
(2)由图可知,1mol氨汽化时吸收热量为cKJ,所以2mol氨汽化时吸收热量为2cKJ,故答案为:吸收;2c;
(3)A、aKJ表示0.5mol N2和1.5mol H2中化学键所吸收的总能量,故A错误;
B、bKJ表示形成1mol NH3中化学键所释放的能量,故B错误;
C、0.5mol N2和1.5mol H2生成1mol NH3(g)所放出的能量可以用(b-a)KJ表示,故C错误;
D、反应放热,说明该反应化学键断裂所吸收的能量小于化学键形成所释放的能量,故D正确.
故选:D.
(2)由图可知,1mol氨汽化时吸收热量为cKJ,所以2mol氨汽化时吸收热量为2cKJ,故答案为:吸收;2c;
(3)A、aKJ表示0.5mol N2和1.5mol H2中化学键所吸收的总能量,故A错误;
B、bKJ表示形成1mol NH3中化学键所释放的能量,故B错误;
C、0.5mol N2和1.5mol H2生成1mol NH3(g)所放出的能量可以用(b-a)KJ表示,故C错误;
D、反应放热,说明该反应化学键断裂所吸收的能量小于化学键形成所释放的能量,故D正确.
故选:D.
点评:本题通过图象考查放热反应的能量变化,注意物质的状态变化时的能量变化,题目难度不大.

练习册系列答案
 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目
改变反应条件使化学平衡向正反应方向移动时,下列变化中正确的是( )
| A、生成物浓度一定增大 |
| B、生成物的物质的量分数一定增大 |
| C、反应物的转化率一定增大 |
| D、某生成物的产率可能提高 |
下列有关元素周期表中元素性质的叙述中正确的是( )
| A、同主族元素从上到下,非金属性逐渐增强 |
| B、元素的最高正化合价均等于它所在的族序数 |
| C、同周期的元素的原子半径越小,越难失去电子 |
| D、元素的非金属性越强,它的最高价氧化物对应的氧化物的氧化性越强 |
下列结论正确的是( )
①粒子半径:K+>Al3+>S2->Cl-
②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO
⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K.
①粒子半径:K+>Al3+>S2->Cl-
②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO
⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K.
| A、只有②⑤⑦ | B、②⑥⑦ |
| C、②④⑤⑥⑦ | D、②④⑥ |
在容积一定的密闭容器中,反应A(?)+B(g)?C(g)+D(g)达到平衡后,升高温度容器内气体的密度增大,则下列说法正确的是( )
| A、正反应是放热反应 |
| B、A不是气态物质,加入A该平衡向正反应方向移动 |
| C、其他条件不变,加入A平衡不移动 |
| D、改变压强对该平衡的移动无影响 |
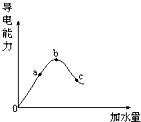 (1)在一定温度下,纯的无水醋酸(又叫冰醋酸)是无色的液体.加水稀释的过程中,溶液的导电能力如图所示.回答:
(1)在一定温度下,纯的无水醋酸(又叫冰醋酸)是无色的液体.加水稀释的过程中,溶液的导电能力如图所示.回答: