题目内容
CuSO4溶液与K2C2O4溶液反应,得到一种蓝色结晶水合物晶体.通过下述实验确定该晶体的组成:
①称取0.168 0g晶体,加入过量的H2SO4溶液,使样品溶解后加入适量水,加热近沸,用0.020 00mol?L-1 KMnO4溶液滴定至终点(溶液变为浅紫红色),消耗20.00mL.
②接着将溶液充分加热,使浅紫红色变为蓝色,此时Mn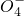 转化为Mn2+并释放出O2
转化为Mn2+并释放出O2
③冷却后加入2g KI固体(过量)和适量Na2CO3,溶液变为棕色并生成沉淀.
④用0.050 00mol?L-1 Na2S2O3溶液滴定,近终点时加指示剂,滴定至终点,消耗10.00mL.
已知:2Mn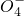 +5H2C2O4+6H+═2Mn2++10CO2↑+8H2O
+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O
2Cu2++4I-═2CuI↓+I2 2Na2S2O3+I2═2NaI+Na2S4O6
(1)步骤②中发生反应的离子方程式为______.
(2)步骤④中加入的指示剂为______.
(3)通过计算写出该蓝色晶体的化学式(写出计算过程).
解:(1)锰元素化合价由MnO4-中+7价降低为Mn2+中+2价,1个Mn2+化合价变化5,氧元素化合价由-2价升高为0价,1个氧气化合价变化4,据化合价升降总数相等,化合价升降的最小公倍数为20,所以Mn2+的系数为4,O2的系数为5,再根据元素守恒(电荷守恒),得方程式为:4MnO4-+12H+═4Mn2++5O2↑+6H2O,
故答案为:4MnO4-+12H+═4Mn2++5O2↑+6H2O;
(2)碘遇淀粉溶液变蓝,当蓝色消失时,表明反应2Na2S2O3+I2═2NaI+Na2S4O6完全进行,故答案为:淀粉溶液;
(3)n(C2O42-)=0.02000mol?L-1×20.00×10-3L× =1.000×10-3mol
=1.000×10-3mol
n(Cu2+)=0.05000mol?L-1×10.00×10-3L=0.5000×10-3mol,
由电荷守恒知,该晶体的化学式为K2[Cu(C2O4)2]?xH2O,
m(H2O)=0.1680g-0.5000×10-3 mol×M[K2Cu(C2O4)2]
=0.1680g-0.5000×10-3mol×318 g?mol-1=0.009g,
n(H2O)=0.009 g/(18 g?mol-1)=0.5000×10-3 mol,
n(H2O):n(Cu2+)=1:1,即x=1,
答:该晶体的化学式为K2[Cu(C2O4)2]?H2O.
分析:(1)由题目信息,可知锰元素化合价由MnO4-中+7价降低为Mn2+中+2价,1个Mn2+化合价变化5,氧元素化合价由-2价升高为0价,1个氧气化合价变化4,据化合价升降总数相等,化合价升降的最小公倍数为20,所以Mn2+的系数为4,O2的系数为5,再根据元素守恒(电荷守恒),配平其它物质的系数;
(2)根据碘遇淀粉溶液变蓝,当蓝色消失时,表明反应2Na2S2O3+I2═2NaI+Na2S4O6完全进行;
(3)先根据方程式2Mn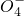 +5H2C2O4+6H+═2Mn2++10CO2↑+8H2O求出n(C2O42-),再根据关系式Cu2+ Na2S2O3求出n(Cu2+),根据电荷守恒可得化学式K2[Cu(C2O4)2]?xH2O,最后根据质量守恒求出x,最终求出化学式.
+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O求出n(C2O42-),再根据关系式Cu2+ Na2S2O3求出n(Cu2+),根据电荷守恒可得化学式K2[Cu(C2O4)2]?xH2O,最后根据质量守恒求出x,最终求出化学式.
点评:本题主要考查了晶体的组成测定,涉及到氧化还原反应的知识,掌握实验的原理是解题的关键,难度中等.
故答案为:4MnO4-+12H+═4Mn2++5O2↑+6H2O;
(2)碘遇淀粉溶液变蓝,当蓝色消失时,表明反应2Na2S2O3+I2═2NaI+Na2S4O6完全进行,故答案为:淀粉溶液;
(3)n(C2O42-)=0.02000mol?L-1×20.00×10-3L×
 =1.000×10-3mol
=1.000×10-3moln(Cu2+)=0.05000mol?L-1×10.00×10-3L=0.5000×10-3mol,
由电荷守恒知,该晶体的化学式为K2[Cu(C2O4)2]?xH2O,
m(H2O)=0.1680g-0.5000×10-3 mol×M[K2Cu(C2O4)2]
=0.1680g-0.5000×10-3mol×318 g?mol-1=0.009g,
n(H2O)=0.009 g/(18 g?mol-1)=0.5000×10-3 mol,
n(H2O):n(Cu2+)=1:1,即x=1,
答:该晶体的化学式为K2[Cu(C2O4)2]?H2O.
分析:(1)由题目信息,可知锰元素化合价由MnO4-中+7价降低为Mn2+中+2价,1个Mn2+化合价变化5,氧元素化合价由-2价升高为0价,1个氧气化合价变化4,据化合价升降总数相等,化合价升降的最小公倍数为20,所以Mn2+的系数为4,O2的系数为5,再根据元素守恒(电荷守恒),配平其它物质的系数;
(2)根据碘遇淀粉溶液变蓝,当蓝色消失时,表明反应2Na2S2O3+I2═2NaI+Na2S4O6完全进行;
(3)先根据方程式2Mn
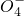 +5H2C2O4+6H+═2Mn2++10CO2↑+8H2O求出n(C2O42-),再根据关系式Cu2+ Na2S2O3求出n(Cu2+),根据电荷守恒可得化学式K2[Cu(C2O4)2]?xH2O,最后根据质量守恒求出x,最终求出化学式.
+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O求出n(C2O42-),再根据关系式Cu2+ Na2S2O3求出n(Cu2+),根据电荷守恒可得化学式K2[Cu(C2O4)2]?xH2O,最后根据质量守恒求出x,最终求出化学式.点评:本题主要考查了晶体的组成测定,涉及到氧化还原反应的知识,掌握实验的原理是解题的关键,难度中等.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目


 移向Y极
移向Y极
