题目内容
【题目】某化学兴趣小组进行实验探究:探究碳、硅元素的非金属性的相对强弱。实验装置如下,请根据要求回答下列问题:
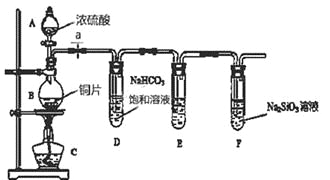
(1)填写所示仪器名称:A 。
(2)实验步骤:连接仪器、 、加药品后,打开a、然后滴入浓硫酸,加热。
(3)问题探究:(已知酸性强弱:亚硫酸 >碳酸)
①铜与浓硫酸反应的化学方程式是 ;装置E中盛足量酸性KMnO4溶液的作用是 。
②该实验证明碳元素的非金属性比硅元素非金属性强的实验依据是 。
③依据试管D中发生的反应,能否证明硫元素的非金属性强于碳元素的非金属性 (填“能”或“否”),原因是 。
【答案】(1)分液漏斗;(2)检查装置的气密性;
(3)①Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O; 除去SO2气体;
CuSO4+SO2↑+2H2O; 除去SO2气体;
②强酸制弱酸:CO2+SiO32-+H2O=H2SiO3↓+CO32-;
③否;亚硫酸不是硫元素的最高价氧化物的水化物(或SO2不是S的最高价氧化物)。
【解析】试题分析:(1)根据装置图可知A仪器名称是分液漏斗;(2)由于该实验中有气体物质参加反应,实验实验步骤首先是连接仪器,待检查装置气密性后再加药品后,打开a、然后滴入浓硫酸,加热。(3)①铜与浓硫酸混合加热,发生反应产生硫酸铜、二氧化硫和水,反应的化学方程式是Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;由于亚硫酸是酸性比碳酸强,实验反应产生的SO2气体与装置D的饱和碳酸钠溶于发生反应产生CO2气体,SO2聚源还原性,E中盛足量酸性KMnO4溶液的作用是除去CO2气体中未反应的SO2,防止干扰CO2的性质;②该实验证明碳元素的非金属性比硅元素非金属性强的实验依据是利用酸性:碳酸比硅酸强,将二氧化碳通入硅酸钠溶液中,发生反应:CO2+SiO32-+H2O=H2SiO3↓+CO32-证明;③由于S元素最高化合价是+6价,而亚硫酸中S元素是+4价,所以不能依据试管D中发生的反应,证明硫元素的非金属性强于碳元素的非金属性。
CuSO4+SO2↑+2H2O;由于亚硫酸是酸性比碳酸强,实验反应产生的SO2气体与装置D的饱和碳酸钠溶于发生反应产生CO2气体,SO2聚源还原性,E中盛足量酸性KMnO4溶液的作用是除去CO2气体中未反应的SO2,防止干扰CO2的性质;②该实验证明碳元素的非金属性比硅元素非金属性强的实验依据是利用酸性:碳酸比硅酸强,将二氧化碳通入硅酸钠溶液中,发生反应:CO2+SiO32-+H2O=H2SiO3↓+CO32-证明;③由于S元素最高化合价是+6价,而亚硫酸中S元素是+4价,所以不能依据试管D中发生的反应,证明硫元素的非金属性强于碳元素的非金属性。

 阅读快车系列答案
阅读快车系列答案【题目】I.(1)已知元素M是组成物质NH4Al(SO4)2的一种元素。元素M的气态原子逐个失去第1个至第4个电子所需能量(即电离能,用符号I1至I4表示)如下表所示:
I1 | I2 | I3 | I4 | |
电离能(kJ·mol-1) | 578 | 1 817 | 2 745 | 11 578 |
元素M是____________(填写元素符号),该元素属于___________区。
(2)硫原子核外有________种不同运动状态的电子,其基态原子中,电子占据的最高能层符号为________,该能层具有的原子轨道数为________。
II.下图为几种晶体或晶胞的示意图:
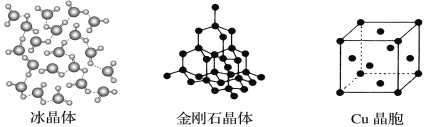
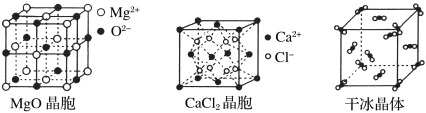
请回答下列问题:
(1)上述晶体中,粒子之间以共价键结合形成的晶体是________________。
(2)冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为__________________。
(3)NaCl晶胞与MgO晶胞相同,NaCl晶体的晶格能________(填“>”或“<”)MgO晶体。
(4)每个Cu晶胞中实际占有____个Cu原子,CaCl2晶体中Ca2+的配位数为____。
(5)冰的熔点远高于干冰,除H2O是极性分子、CO2是非极性分子外,还有一个重要的原因是________________________________。

