题目内容
10.实验室欲配制2L 0.5mol•L-1 NaCl溶液,不必用到的仪器是( )| A. | 量筒 | B. | 天平 | C. | 容量瓶 | D. | 烧杯 |
分析 根据配制一定物质的量浓度的溶液步骤为:计算、溶解、移液、洗涤、定容、摇匀等,根据配制步骤判断使用的仪器.
解答 解:配制2L 0.5mol•L-1 NaCl溶液的步骤为:计算、溶解、移液、洗涤、定容、摇匀等,使用的仪器有:托盘天平、容量瓶、烧杯、玻璃杯、胶头滴管等,由于氯化钠为固体,使用不必使用量筒,
故选A.
点评 本题考查了配制一定物质的量浓度的溶液方法,题目难度不大,明确配制一定屋子里的浓度的溶液步骤为解答关键,注意掌握常见仪器的构造及使用方法.

练习册系列答案
相关题目
20.下列反应的离子方程式中,正确的是( )
| A. | 向硝酸银溶液中加盐酸:Ag++Cl-═AgCl↓ | |
| B. | 碳酸氢钙溶液跟盐酸反应:Ca(HCO3)2+2H+═Ca2++2H2O+2CO2↑ | |
| C. | 盐酸跟氢氧化镁反应:H++OH-═H2O | |
| D. | 碳酸镁跟硫酸反应:MgCO3+H+═Mg2++H2O+CO2↑ |
18.毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2•2H2O的流程如下:
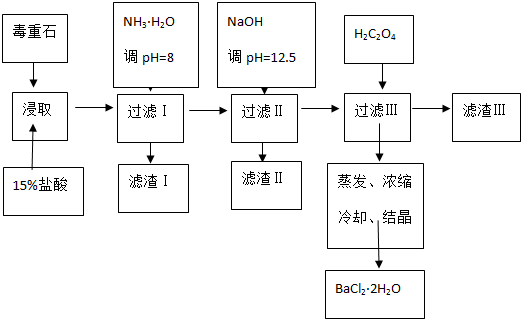
(1)毒重石用盐酸浸取前需充分研磨,目的是增大接触面积从而使反应速率加快.实验室用37%的盐酸配置15%的盐酸,除量筒外还需使用下列仪器中的ac.
a.烧杯 b.容量瓶 c.玻璃棒 d.滴定管
(2)已知:
加入NH3•H2O调节pH=8可除去Fe3+;(填离子符号),滤渣Ⅱ中含Mg(OH)2、Ca(OH)2(填化学式).加入H2C2O4时应避免过量,原因是H2C2O4过量会导致生成BaC2O4沉淀,产品的产量减少.
已知:Ksp(BaC2O4)=1.610-7,Ksp(CaC2O4)=2.310-9
(3)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行.
已知:2CrO42-+2H+═Cr2O72-+H20 Ba2++CrO42-═BaCrO4↓
步骤Ⅰ移取xml一定浓度的Na2CrO4溶液与锥形瓶中,加入酸碱指示剂,用bmol•L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0mL.
步骤Ⅱ:移取y mLBaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL.
试回答:滴加盐酸标准液时应用酸式滴定管,“0”刻度位于滴定管的上方(填“上方”或“下方”).BaCl2溶液的浓度为$\frac{(V{\;}_{0}-V{\;}_{1})b}{y}$mol•L-1,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将偏大(填“偏大”或“偏小”).

(1)毒重石用盐酸浸取前需充分研磨,目的是增大接触面积从而使反应速率加快.实验室用37%的盐酸配置15%的盐酸,除量筒外还需使用下列仪器中的ac.
a.烧杯 b.容量瓶 c.玻璃棒 d.滴定管
(2)已知:
| Ca2+ | Mg2+ | Fe3+ | |
| 开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
已知:Ksp(BaC2O4)=1.610-7,Ksp(CaC2O4)=2.310-9
(3)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行.
已知:2CrO42-+2H+═Cr2O72-+H20 Ba2++CrO42-═BaCrO4↓
步骤Ⅰ移取xml一定浓度的Na2CrO4溶液与锥形瓶中,加入酸碱指示剂,用bmol•L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0mL.
步骤Ⅱ:移取y mLBaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL.
试回答:滴加盐酸标准液时应用酸式滴定管,“0”刻度位于滴定管的上方(填“上方”或“下方”).BaCl2溶液的浓度为$\frac{(V{\;}_{0}-V{\;}_{1})b}{y}$mol•L-1,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将偏大(填“偏大”或“偏小”).
15.下列事实能证明碳的非金属性比硅强的是( )
①Na2SiO3+CO2+2H2O═H4SiO4↓+Na2CO3 ②SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑
③Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑ ④CH4比SiH4稳定.
①Na2SiO3+CO2+2H2O═H4SiO4↓+Na2CO3 ②SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑
③Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑ ④CH4比SiH4稳定.
| A. | ①④ | B. | ①②④ | C. | ②④ | D. | ①②③④ |
19.在下列各溶液中,一定可以大量共存的离子组是( )
| A. | 室温下,pH=1的溶液中:K+、Fe2+、ClO-、SO42- | |
| B. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1012的溶液:Cu2+、Na+、SO42-、NO3- | |
| C. | 加入铝粉产生大量氢气的溶液中:Na+、NH4+、NO3-、SO42- | |
| D. | 在0.1 mol•L-1 Fe3+溶液中:K+、Na+、HCO3-、SO42- |
2.化学与社会、生活密切相关,下列有关说法正确的是( )
| A. | 氮化硅陶瓷、有机玻璃是传统无机非金属材料 | |
| B. | 瓷坩埚能耐高温,可以用于加热分解石灰石 | |
| C. | 青铜是我国使用最早的合金材料,目前世界上使用量最大的合金材料是钢铁 | |
| D. | SO2具有氧化性,可用于漂白纸浆 |
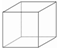 ,其六氯代物有3种;
,其六氯代物有3种;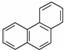 ,其二氯代物的数目为25种;
,其二氯代物的数目为25种;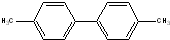 ),其二氯代物有16种.
),其二氯代物有16种.