题目内容
1.下列排列顺序不正确的是( )| A. | 原子半径:Al<Mg<Na | B. | 热稳定性:HI>HBr>HCl>HF | ||
| C. | 酸性:H2SiO3<H3PO4<H2SO4<HClO4 | D. | 碱性:Al(OH)3<Mg(OH)2<NaOH |
分析 A.同一周期中,原子序数越大,原子半径越小;
B.非金属性越强,氢化物的稳定性越强;
C.非金属性越强,最高价含氧酸的酸性越强;
D.金属性越强,最高价氧化物对应水合物的碱性越强.
解答 解:A.Na、Mg、Al位于同一周期,原子序数逐渐增大,原子半径逐渐减小,则原子半径:Al<Mg<Na,故A正确;
B.非金属性:I<Br<Cl<F,则氢化物的热稳定性:HI<HBr<HCl<HF,故B错误;
C.非金属性:Si<P<S<Cl,则最高价含氧酸的酸性:H2SiO3<H3PO4<H2SO4<HClO4,故C正确;
D.金属性:Al<Mg<Na,则最高价氧化物对应水合物的碱性:Al(OH)3<Mg(OH)2<NaOH,故D正确;
故选B.
点评 本题考查了原子结构与元素周期律的关系,题目难度不大,明确元素周期律内容为解答关键,注意熟练掌握元素周期律内容、元素周期表结构,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
相关题目
1.下列各组物质中,在高温引燃的条件下,不能发生化学反应的是( )
| A. | Al粉和Fe3O4粉末混合 | B. | V2O5粉末和Al粉混合 | ||
| C. | Al粉和MgO粉末混合 | D. | C粉和CuO粉末混合 |
12.230Th和232Th是钍的两种同位素,232Th可以转化成${\;}_{92}^{233}$U.下列有关Th的说法正确的是( )
| A. | Th元素的质量数是231 | B. | ${\;}_{92}^{233}$U的中子数为92 | ||
| C. | 232Th的摩尔质量为232 | D. | 230Th和232Th的化学性质相同 |
13.已知CHCl=CHCl有两种同分异构体,则化学式为C3H5Cl的链状的同分异构体共有( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
11.下列关于卤代烃的叙述正确的是( )
| A. | 所有卤代烃是难溶于水,比水重的液体 | |
| B. | 所有卤代烃在适当条件下都能发生消去反应 | |
| C. | 所有卤代烃都含有卤素原子 | |
| D. | 所有卤代烃都是通过取代反应制得的 |
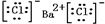 ,⑤的电子式是
,⑤的电子式是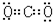 .
.