题目内容
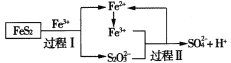
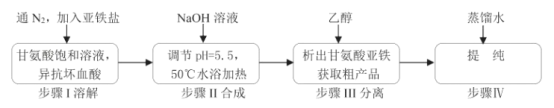
【题目】甘氨酸亚铁络合物[(H2NCH2COO)2Fe]是一种新型的铁营养强化剂,广泛用于缺铁性贫血的预防和治疗。某学习小组模拟其合成方法如图:
已知:

请回答:
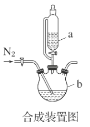
(1)合成装置中仪器b的名称是___。
(2)合成过程中,本实验为了防止Fe2+被氧化,采取的措施是___。
(3)写出水浴加热过程中生成甘氨酸亚铁络合物的离子方程式___。
(4)下列说法正确的是___。
A.滴入液体前,应先打开滴液漏斗a的上口玻璃塞
B.根据题中所给信息,亚铁盐应选用FeSO4·7H2O
C.步骤Ⅲ中的分离方法是过滤
D.步骤IV,提纯操作中的干燥过程最好选用真空干燥
(5)合成过程需控制pH=5.5,试说明理由___。
(6)步骤Ⅲ加入无水乙醇的目的是___。
(7)若甘氨酸的投料量为300kg,得到纯品344.8kg,则产品的产率为___ %(保留一位小数)。
【答案】三颈烧瓶 通入氮气,加入异抗坏血酸 2H2NCH2COOH+Fe2+=[(H2NCH2COO)2Fe]+2H+ CD pH过低,H+会与H2NCH2COOH中的氨基反应,使产率下降,pH过高会生成氢氧化亚铁沉淀 降低甘氨酸亚铁在水中的溶解度,促使其结晶析出;除去杂质,提高产率和纯度 84.5
【解析】
(1)根据图示中装置的结构分析解答;
(2)亚铁离子易被氧气氧化,结合过程中通入的氮气和异抗坏血酸的性质分析解答;
(3)甘氨酸亚铁易溶于水,水浴加热甘氨酸饱和溶液和硫酸亚铁的混合物反应生成甘氨酸亚铁络合物,据此书写反应的离子方程式;
(4)根据装置图中中使用的是恒压滴液漏斗的结构判断A;根据FeSO4·7H2O易溶于水,难溶于乙醇,FeCl2·4H2O易溶于乙醇,结合合成过程分析判断B;步骤Ⅲ为分离液体和固体的操作据此判断C;甘氨酸亚铁容易被氧化,据此判断D;
(5)pH过低,H+会与H2NCH2COOH中的氨基反应,pH过高会生成氢氧化亚铁沉淀,据此分析解答;
(6)根据甘氨酸亚铁易溶于水,难溶于乙醇,结合合成过程分析解答;
(7)根据氮原子守恒,结合产率=![]() ×100%计算。
×100%计算。
(1)根据图示,合成装置中仪器b为三颈烧瓶,故答案为:三颈烧瓶;
(2)甘氨酸饱和溶液中通入氮气,气流通过溶液,能起搅拌溶液的作用,搅拌可以加快化学反应速率,同时除去溶液中溶解的氧气,加入异抗坏血酸,异抗坏血酸介于弱酸性和强还原性,都能防止亚铁离子被氧气氧化,故答案为:通入氮气,加入异抗坏血酸;
(3)甘氨酸亚铁络合物易溶于水,水浴加热甘氨酸饱和溶液和硫酸亚铁的混合物反应生成甘氨酸亚铁络合物,反应的离子方程式为:2NH2CH2COOH+Fe2+=(NH2CH2COO)2Fe+2H+,加入氢氧化钠使反应能够完全进行,故答案为: 2NH2CH2COOH+Fe2+=(NH2CH2COO)2Fe+2H+;
(4)A.装置中使用的是恒压滴液漏斗,滴入液体前,无需打开滴液漏斗a的上口玻璃塞,故A错误;B. FeSO4·7H2O易溶于水,难溶于乙醇,在加入乙醇析出甘氨酸亚铁时会混入杂质,而FeCl2·4H2O易溶于乙醇,不会引入杂质,因此亚铁盐应选用FeCl2·4H2O,故B错误;C. 加入乙醇析出甘氨酸亚铁,步骤Ⅲ为分离液体和固体的操作,分离方法是过滤,故C正确;D.步骤IV中,用蒸馏水洗涤除去乙醇,得到纯净的甘氨酸亚铁,甘氨酸亚铁容易被氧化,因此干燥过程最好选用真空干燥,故D正确;故答案为:CD;
(5)pH过低,H+会与H2NCH2COOH中的氨基反应,使产率下降,pH过高会生成氢氧化亚铁沉淀,因此合成过程需控制pH=5.5,故答案为:pH过低,H+会与H2NCH2COOH中的氨基反应,使产率下降,pH过高会生成氢氧化亚铁沉淀;
(6)甘氨酸亚铁易溶于水,难溶于乙醇,步骤Ⅲ加入无水乙醇,降低甘氨酸亚铁在水中的溶解度,促使其结晶析出;同时除去杂质,提高甘氨酸亚铁的产率和纯度,故答案为:降低甘氨酸亚铁在水中的溶解度,促使其结晶析出;除去杂质,提高产率和纯度;
(7)甘氨酸的投料量为300kg,甘氨酸的物质的量n=![]() =4×103mol,生成n[(NH2CH2COO)2Fe]=2×103mol,产率为=
=4×103mol,生成n[(NH2CH2COO)2Fe]=2×103mol,产率为=![]() ×100%=84.5%,故答案为:84.5。
×100%=84.5%,故答案为:84.5。

 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案