题目内容
8.H是从天然水果中提取出的一种有机物,其相对分子质量是134,H具有下列性质:| H的性质 | 推断H的组成和结构 |
| H完全燃烧的产物只有CO2和H2O | 组成:肯定含碳、氢两种元素,也可能含氧元素 |
| H与乙醇在一定条件下反应均能生成具有果香味的物质,且结构中只存在两种官能团 | 组成:含有O元素 |
| 1.34gH分别与足量的碳酸氢钠溶液和钠反应,生成标准状况下的气体体积分别为0.448L和0.336L | 组成:含有两个-COOH、一个-OH |
| H的碳链无支链 | 结构简式:HOOCCH(OH)CH2COOH |
(2)多溴代烃X经过多步反应可人工合成H,其合成路线为:X→有机物A→有机物B→有机物C→H,其中B能发生银镜反应.
①X的结构简式为BrCH2CH(Br)CH2CH2Br;
②C→H的化学方程式为HOOCCOCH2COOH+H2$\stackrel{一定条件下}{→}$HOOCCH(OH)CH2COOH.
分析 (1)H完全燃烧的产物只有CO2和H2O,根据元素守恒知,H中一定含有C、H元素,可能含有O元素;
H与乙醇在一定条件下反应均能生成具有果香味的物质,且结构中只存在两种官能团,说明H中含有羧基,则H中含有O元素;
1.34gH分别与足量的碳酸氢钠溶液和钠反应,n(H)=$\frac{1.34g}{134g/mol}$=0.01mol,生成标准状况下的气体体积分别为0.448L和0.336L,只有羧基能和碳酸氢钠反应生成二氧化碳,则n(CO2)=$\frac{0.448L}{22.4L/mol}$=0.02mol,羧基和羟基都与钠反应生成氢气n(H2)=$\frac{0.336L}{22.4L/mol}$=0.015mol,反应中n(-COOH)=n(CO2)=0.002mol,则每个H分子中含有2个-COOH,0.01molH中羧基和足量钠反应生成n(H2)=0.01mol,则还有0.005mol氢气是钠与-OH反应得到的,n(-OH)=2×0.005mol=0.01mol,所以H分子中含有1个-OH,
H碳链没有支链,H分子中碳链上碳原子个数=$\frac{134-45×2-17}{12}$=2…3,
则H分子式为C4H6O3,结合其结构确定结构简式;
(2)多溴代烃X经过多步反应可人工合成H,其合成路线为:X→有机物A→有机物B→有机物C→H,其中B能发生银镜反应,B中含有醛基,A为醇,X发生水解反应生成A,A发生催化氧化反应生成B,B发生氧化反应生成C,C发生还原反应生成H,则X结构简式为BrCH2CH(Br)CH2CH2Br、A为HOCH2CH(OH)CH2CH2OH、B为OHCCOCH2CHO、C为HOOCCOCH2COOH,据此分析解答.
解答 解:(1)H完全燃烧的产物只有CO2和H2O,根据元素守恒知,H中一定含有C、H元素,可能含有O元素;
H与乙醇在一定条件下反应均能生成具有果香味的物质,且结构中只存在两种官能团,说明H中含有羧基,则H中含有O元素;
1.34gH分别与足量的碳酸氢钠溶液和钠反应,n(H)=$\frac{1.34g}{134g/mol}$=0.01mol,生成标准状况下的气体体积分别为0.448L和0.336L,只有羧基能和碳酸氢钠反应生成二氧化碳,则n(CO2)=$\frac{0.448L}{22.4L/mol}$=0.02mol,羧基和羟基都与钠反应生成氢气n(H2)=$\frac{0.336L}{22.4L/mol}$=0.015mol,反应中n(-COOH)=n(CO2)=0.002mol,则每个H分子中含有2个-COOH,0.01molH中羧基和足量钠反应生成n(H2)=0.01mol,则还有0.005mol氢气是钠与-OH反应得到的,n(-OH)=2×0.005mol=0.01mol,所以H分子中含有1个-OH,
H碳链没有支链,H分子中碳链上碳原子个数=$\frac{134-45×2-17}{12}$=2…3,
则H分子式为C4H6O3,结合其结构确定其结构简式为HOOCCH(OH)CH2COOH,
故答案为:含有O元素;含有2个-COOH、1个-OH;HOOCCH(OH)CH2COOH;
(2)多溴代烃X经过多步反应可人工合成H,其合成路线为:X→有机物A→有机物B→有机物C→H,其中B能发生银镜反应,B中含有醛基,A为醇,X发生水解反应生成A,A发生催化氧化反应生成B,B发生氧化反应生成C,C发生还原反应生成H,则X结构简式为BrCH2CH(Br)CH2CH2Br、A为HOCH2CH(OH)CH2CH2OH、B为OHCCOCH2CHO、C为HOOCCOCH2COOH,
①X的结构简式为BrCH2CH(Br)CH2CH2Br,故答案为:BrCH2CH(Br)CH2CH2Br;
②C为HOOCCOCH2COOH、H为HOOCCH(OH)CH2COOH,C发生还原反应生成H,C→H的化学方程式为:HOOCCOCH2COOH+H2$\stackrel{一定条件下}{→}$HOOCCH(OH)CH2COOH,
故答案为:HOOCCOCH2COOH+H2$\stackrel{一定条件下}{→}$HOOCCH(OH)CH2COOH.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断能力,正确判断H结构简式是解本题关键,熟悉常见有机物的官能团及其性质、反应类型,注意知识的综合运用,题目难度不大.

 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案| A. | 只要是氧化还原反应原理都可以设计成原电池 | |
| B. | Cu+2H+═Cu2++H2↑在任何条件下都不能进行 | |
| C. | 金属的防护可以采取制成合金,改变内部结构的方法 | |
| D. | 现代潜艇的防腐是在潜艇底部贴锌板 |
| A. | 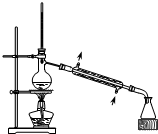 从煤焦油中提取苯 | B. | 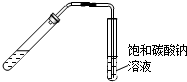 实验室制乙酸乙酯 | ||
| C. | 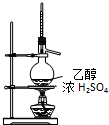 实验室制乙烯 | D. | 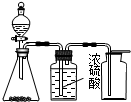 实验室制取、收集乙炔气体 |
| A. | 稀硫酸 | B. | 食盐水 | ||
| C. | 石灰水 | D. | 稀盐酸和澄清石灰水 |
| A. |  1,4-二甲基丁 1,4-二甲基丁 | B. | 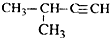 3-甲基丁炔 3-甲基丁炔 | C. | 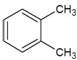 二甲基苯 二甲基苯 | D. | 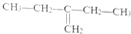 2-乙基-1-丁烯 2-乙基-1-丁烯 |
 利用生活中常见的材料可以进行很多科学实验,下图就是一个用废旧材料制作的可用于驱动玩具的电池的示意图.当电池工作时,有关说法中正确的是( )
利用生活中常见的材料可以进行很多科学实验,下图就是一个用废旧材料制作的可用于驱动玩具的电池的示意图.当电池工作时,有关说法中正确的是( )| A. | 铝罐不会被腐蚀 | |
| B. | 木炭棒上发生的反应为O2+2H2O+4e-═4OH- | |
| C. | 木炭棒应与玩具电机的负极相连 | |
| D. | 该电池工作一段时间后木炭棒和碳粒的质量会减轻 |
| A. | 原子半径:R>Z>Y | |
| B. | X的最简单气态氢化物分子中含有18个电子 | |
| C. | Y与Z形成的常见化合物既能与酸反应,又能与碱反应 | |
| D. | 同周期元素中R的最高价氧化物对应水化物的酸性最强 |
 酚类
酚类 芳香烃
芳香烃  酯类
酯类 羧酸类
羧酸类