题目内容
【题目】水的电离平衡曲线如图所示。
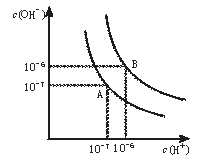
(1)若以A点表示25℃时水在电离平衡时的离子浓度,当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从___增加到___。
(2)将100℃的pH=8的Ba(OH)2溶液与100℃的pH=5的稀盐酸混合,并保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为___。
(3)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为(填序号)___。
A.9 B.13 C.11~13之间 D.9~11之间
(4)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号)___。
A.氨水与氯化铵发生化学反应
B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH-)减小
(5)室温下,如果将0.1molNH4Cl和0.05molNaOH全部溶于水,形成混合溶液(假设无损失),
①___和____两种粒子的物质的量之和等于0.1mol。
②___和___两种粒子的物质的量之和比OH-多0.05mol。
【答案】10-14 10-12 2:9 D C NH3·H2O NH4+ NH4+ H+
【解析】
(1)若以A点表示25℃时水在电离平衡时的离子浓度,当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从10-7×10-7增加到10-6×10-6;
(2)设Ba(OH)2溶液的体积为V1,稀盐酸的体积为V2,则![]() ,由此可求出V1:V2,则可以计算出Ba(OH)2与盐酸的体积比;
,由此可求出V1:V2,则可以计算出Ba(OH)2与盐酸的体积比;
(3)在25℃条件下将pH=11的氨水稀释100倍后,由于氨水的电离度增大,所以10-5mol/L< c(OH-)<10-3mol/L,从而得出溶液的pH;
(4)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是氯化铵电离生成的NH4+抑制氨水的电离,从而使氨水的电离平衡逆向移动;
(5)室温下,如果将0.1molNH4Cl和0.05molNaOH全部溶于水,形成混合溶液中,n(NH4Cl)=0.05mol,n(NH3·H2O)=0.05mol,n(NaCl)=0.05mol,在溶液中,存在下列两个电离平衡:NH3·H2O![]() NH
NH![]() + OH-,H2O
+ OH-,H2O![]() H++OH-;若假设电离的n(NH3·H2O)电离=x,则平衡后的溶液中,n(NH3·H2O)平=0.05-x,n(NH4+)=0.05+x,c(OH-) =x+ n(H+)。由此得出:
H++OH-;若假设电离的n(NH3·H2O)电离=x,则平衡后的溶液中,n(NH3·H2O)平=0.05-x,n(NH4+)=0.05+x,c(OH-) =x+ n(H+)。由此得出:
①NH3·H2O和NH4+两种粒子的物质的量之和等于0.1mol;
②NH4+和H+两种粒子的物质的量之和比OH-多0.05mol。
(1)若以A点表示25℃时水在电离平衡时的离子浓度,当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从10-14增加到10-12;
答案为:10-14;10-12;
(2)设Ba(OH)2溶液的体积为V1,稀盐酸的体积为V2,则![]() ,由此可求出V1:V2=2:9,则Ba(OH)2与盐酸的体积比为2:9。答案为2:9;
,由此可求出V1:V2=2:9,则Ba(OH)2与盐酸的体积比为2:9。答案为2:9;
(3)在25℃条件下将pH=11的氨水稀释100倍后,由于氨水的电离度增大,所以10-5mol/L< c(OH-)<10-3mol/L,10-11mol/L< c(H+)<10-9mol/L,从而得出溶液的pH为9~11之间;
答案为:D;
(4)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是氯化铵电离生成的NH4+抑制氨水的电离,从而使氨水的电离平衡逆向移动;
答案为:C;
(5)室温下,如果将0.1molNH4Cl和0.05molNaOH全部溶于水,形成混合溶液中,n(NH4Cl)=0.05mol,n(NH3·H2O)=0.05mol,n(NaCl)=0.05mol,在溶液中,存在下列两个电离平衡:NH3·H2O![]() NH
NH![]() + OH-,H2O
+ OH-,H2O![]() H++OH-。
H++OH-。
若假设电离的n(NH3·H2O)电离=x,则平衡后的溶液中,n(NH3·H2O)平=0.05-x,n(NH4+) =0.05+x,c(OH-) =x+ n(H+),由此得出:
①NH3·H2O和NH4+两种粒子的物质的量之和等于0.1mol;
答案为:NH3·H2O;NH4+;
②NH4+和H+两种粒子的物质的量之和比OH-多0.05mol;
答案为:NH4+;H+。

 同步练习强化拓展系列答案
同步练习强化拓展系列答案【题目】下列实验方案不能达到相应目的的是
A | B | C | D | |
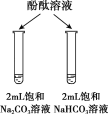
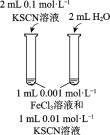
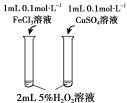
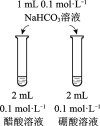
目的 | 比较碳酸根与碳酸氢根水解程度 | 研究浓度对化学平衡的影响 | 比较不同催化剂对化学反应速率的影响 | 比较碳酸、醋酸和硼酸的酸性强弱 |
实验方案 |
|
|
|
|
A. AB. BC. CD. D