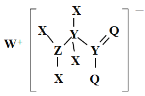题目内容
【题目】现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第4周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
元素 | 相关信息 |
A | 元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
B | 元素原子的核外p电子数比s电子数少1 |
C | 原子的第一至第四电离能分别是I1=738 kJ·mol-1; I2=1 451 kJ·mol-1;I3=7 733 kJ·mol-1;I4=10 540 kJ·mol-1 |
D | 原子核外所有p轨道全满或半满 |
E | 元素的主族序数与周期数的差为4 |
F | 是前四周期中电负性最小的元素 |
G | 在周期表的第七列 |
(1)B基态原子中能量最高的电子,其电子云在空间有______个伸展方向,原子轨道呈________形。
(2)某同学根据上述信息,推断C基态原子的轨道表示式为![]() 该同学所画的轨道表示式违背了________________。
该同学所画的轨道表示式违背了________________。
(3)G位于______族__________区,价电子排布式为________________。
(4)检验F元素的方法是________,请用原子结构的知识解释产生此现象的原因:_____________。
(5)写出E的单质与水反应的离子方程式:_____________________________________
(6)写出DA3的电子式_______________________(用元素符号)
【答案】3 哑铃 泡利原理 ⅦB d 3d54s2 焰色反应 基态原子的电子吸收能量后,电子会跃迁到较高的能级,变成激发态电子,电子从能量较高的激发态跃迁到较低能量的激发态或基态时,将以光的形式释放能量 Cl2+H20==H++Cl-+HClO ![]()
【解析】
A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素,A为H元素;
B元素原子的核外p电子数比s电子数少1,B有2个电子层,为1s22s22p3,故B为N元素;
由C原子的第一至第四电离能数据可知,第三电离能突然增大,故C表现+2价,处于ⅡA族,原子序数大于N元素,故C为Mg元素;
D处于第三周期,D原子核外所有p轨道全满或半满,最外层排布为3s23p3,故D为P元素;
E处于第三周期,E元素的主族序数与周期数的差为4,E处于第ⅦA族,故E为Cl元素;
F是前四周期中电负性最小的元素,F为第四周期元素,故F为K元素,
G在第四周期周期表的第7列,G为Mn元素。
(1)(1)B是N原子,基态原子中能量最高的电子排布在2p能级上,其电子云在空间有px、py、pz 3个伸展方向,原子轨道呈哑铃形。
(2) 根据泡利不相容原理,1个原子轨道只能容纳2个自旋方向相反的电子,该同学所画的电子排布图中3s能级,2个电子自旋方向相同,违背了泡利原理;
(3)G为Mn元素,是25号元素,位于第四周期第ⅦB族,最后填充的为d电子,为d区元素,价电子排布式为3d54s2;
(4) 当基态原子的电子吸收能量后,电子会跃迁到较高的能级,变成激发态电子,电子从能量较高的激发态跃迁到较低能量的激发态或基态时,将以光的形式释放能量;含有K元素的溶液在酒精灯火焰上灼烧时,透过蓝色钴玻璃能观察到紫色火焰,检验K元素的方法是焰色反应。
(5)E是Cl元素,氯气与水反应生成盐酸和次氯酸,反应的离子方程式是Cl2+H2O==H++Cl-+HClO;
(6)PH3中心原子P原子满足8电子稳定结构,电子式为![]() 。
。