题目内容
15.海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在.实验室里从海带中提取碘的流程如下:
(1)指出提取碘的过程中有关的实验操作名称:④蒸馏.
(2)步骤①中用到的玻璃仪器有烧杯、漏斗、玻璃棒;
(3)步骤③中不可选用的有机试剂是C.
A.汽油. B.苯 C.酒精 D.四氯化碳.
分析 (1)分离固体和溶液通常采用过滤操作,分离互溶液体,有机沸点不同通常采用蒸馏的方法;
(2)分离固体和溶液通常采用过滤操作,有机过滤装置选择仪器;
(3)根据萃取操作中,萃取剂不能与原溶液相溶,萃取的基本原则两种溶剂互不相溶,且溶质在一种溶剂中的溶解度比在另一种大的多,而酒精与水溶液互溶分析.
解答 解:(1)根据流程可知,将碘单质与四氯化碳分离的操作方法为蒸馏,
故答案为:蒸馏;
(2)步骤①是分离固体和液体混合物,分离不溶物与溶液的方法为过滤,步骤中用到的玻璃仪器有烧杯、漏斗、玻璃棒,
故答案为:烧杯、漏斗、玻璃棒;
(3)萃取的基本原则两种溶剂互不相溶,且溶质在一种溶剂中的溶解度比在另一种大的多,故可用汽油、四氯化碳或苯,酒精与水溶液互溶,溶液不分层,无法用于分液操作分离碘单质,
故答案为:C.
点评 本题考查物质的分离和提纯,学习中注意掌握过滤、萃取、蒸馏等操作,掌握基础是解题关键,题目较简单.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案
相关题目
5.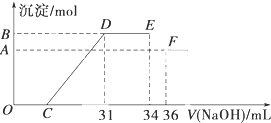 某研究性学习小组对铝热反应实验展开研究.现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3的熔点、沸点数据如下:
某研究性学习小组对铝热反应实验展开研究.现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3的熔点、沸点数据如下:
Ⅰ.(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金.理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金.你认为他的解释是否合理?合理(填“合理”或“不合理”).
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝.该实验所用试剂NaOH溶液,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)实验室溶解该熔融物,在下列试剂中最适宜的试剂是B(填序号).
A.浓硫酸 B.稀硫酸
C.稀硝酸 D.氢氧化钠溶液.
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量上述的熔融物与过量的很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol•L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:
(1)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为H++OH-═H2O.
(2)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为NH4++OH-═NH3•H2O;上述现象说明溶液中Al3+、Fe3+、H+结合OH-的能力比NH4+强(填离子符号).
(3)B与A的差值为0.08mol.
(4)B点对应的沉淀的物质的量为0.032mol,C点对应的氢氧化钠溶液的体积为7mL.
 某研究性学习小组对铝热反应实验展开研究.现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3的熔点、沸点数据如下:
某研究性学习小组对铝热反应实验展开研究.现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3的熔点、沸点数据如下:| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | - |
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝.该实验所用试剂NaOH溶液,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)实验室溶解该熔融物,在下列试剂中最适宜的试剂是B(填序号).
A.浓硫酸 B.稀硫酸
C.稀硝酸 D.氢氧化钠溶液.
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量上述的熔融物与过量的很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol•L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:
(1)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为H++OH-═H2O.
(2)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为NH4++OH-═NH3•H2O;上述现象说明溶液中Al3+、Fe3+、H+结合OH-的能力比NH4+强(填离子符号).
(3)B与A的差值为0.08mol.
(4)B点对应的沉淀的物质的量为0.032mol,C点对应的氢氧化钠溶液的体积为7mL.
6.已知下述三个实验均能发生化学反应.①将铁钉放入硫酸铜溶液中;②向硫酸亚铁溶液中滴入几滴浓硝酸;③将铁钉放入氯化铁溶液中.下列判断正确的是( )
| A. | 实验①和③中的铁钉只作还原剂 | |
| B. | 上述实验证明氧化性:Fe3+>Fe2+>Cu2+ | |
| C. | 实验②中Fe2+既显氧化性又显还原性 | |
| D. | 实验③中反应的离子方程式为2Fe+Fe3+═3Fe2+ |
3.X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
(1)Y离子半径>Z离子半径(选填“>”、“=”、“<”).
(2)XY2是一种常用的溶剂,一个XY2的分子中存在2个σ键,2个π键.
(3)在H-Y、H-Z两种共价键中,键的极性较强的是H-Cl,键长较长的是F-S.
(4)向WYO4的水溶液中逐滴加入氨水至过量,观察到溶液由天蓝色最终变为深蓝色.反应过程中涉及的离子方程式为:Cu2++2NH3•H2O=Cu(OH)2+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-.
| 元素 | 相 关 信 息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | Y元素的激发态原子的电子排布式为1s22s22p63s23p34s1 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
(2)XY2是一种常用的溶剂,一个XY2的分子中存在2个σ键,2个π键.
(3)在H-Y、H-Z两种共价键中,键的极性较强的是H-Cl,键长较长的是F-S.
(4)向WYO4的水溶液中逐滴加入氨水至过量,观察到溶液由天蓝色最终变为深蓝色.反应过程中涉及的离子方程式为:Cu2++2NH3•H2O=Cu(OH)2+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-.
20.蓝紫色的硅酸铜钡的化学式为(BaCuSi2Ox,铜为+2价),下列关于硅酸铜钡的说法不正确的是( )
| A. | 可用氧化物形式表示为BaO•CuO•2SiO2 | |
| B. | 性质稳定,不易脱色 | |
| C. | 易溶解于强酸和强碱 | |
| D. | x等于6 |
7.如图是某化学反应的示意图(“○”与“o”分别代表不同元素原子),该反应可能为( )


| A. | 氢气的燃烧 | B. | 水的电解 | C. | 甲烷的燃烧 | D. | 一氧化碳的燃烧 |
4.1mol/L H2SO4的含义是( )
| A. | 1L水中含有1molH2SO4 | B. | 1L溶液中含有1molH+ | ||
| C. | 1LH2SO4溶液中含98g H2SO4 | D. | 将98g H2SO4溶于1L水配成溶液 |
4.CoCl2•6H2O是一种饲料营养强化剂,一种利用水钴矿[主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、•Al2O3、MnO等]制取CoCl2•6H2O的工艺流程如下:
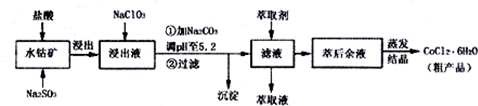
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表.
(1)盐酸的作用是溶解矿石,提供酸性环境,Na2SO3的作用是(文字描述)将Fe3+、Co3+还原.
(2)NaClO3加入浸出液后生成NaCl,写出反应的离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O.
(3)加Na2CO3调pH至5.2的目的是为完全沉淀Fe3+、Al3+.
(4)萃取剂对金属离子的萃取率与pH的关系如图1,萃取剂的作用是除去溶液中的Mn2+,其使用的适宜pH范围是C.A.1.0~2.0 B.2.0~2.5 C.3.0~3.5 D 4.0~4.5
(5)取部分加入萃取剂后的混合液,在实验室按流程图获得粗产品.
①使用分液漏斗前要检漏,是检查玻璃塞、旋塞芯是否漏水,若发现其中一处漏水,必要的操作或做法是若发现玻璃塞处漏水,更换分液漏斗,若发现旋塞芯处漏水,则用纸或干布擦净旋塞或旋塞孔,在旋塞芯上涂一层薄薄的润滑脂,将旋塞芯塞进旋塞内,旋转数圈,使润滑脂均匀分布后将旋塞关闭好.(只写出其中一种漏水对应的操作或做法)
②在蒸发过程中为防止产生杂质或脱水,当较多晶体析出时,改为抽滤得到晶体.
写出抽滤装置(如图2)中指定仪器的名称:A安全瓶,B抽气泵.
下列抽滤操作或说法正确的是ABE
A.用蒸馏水润湿滤纸,微开水龙头,抽气使滤纸紧贴在漏斗瓷板上
B.用倾析法转移溶液,开大水龙头,待溶液快流尽时再转移沉淀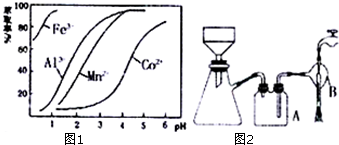
C.注意吸滤瓶内液面高度,当接近支管口位置时,拨掉橡皮管,滤液从支管口倒出
D.用抽滤洗涤沉淀时,应开大水龙头,使洗涤剂快速通过沉淀物,以减少沉淀物损失
E.抽滤不宜用于过滤胶状或颗粒太小的沉淀
用少量蒸馏水洗涤晶体,判断晶体是否洗净的具体操作是用洁净的铂丝蘸取最后一次洗涤液在酒精灯火焰上灼烧,如果看到黄色火焰,说明没有洗净,否则已洗净.

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表.
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)2 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(2)NaClO3加入浸出液后生成NaCl,写出反应的离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O.
(3)加Na2CO3调pH至5.2的目的是为完全沉淀Fe3+、Al3+.
(4)萃取剂对金属离子的萃取率与pH的关系如图1,萃取剂的作用是除去溶液中的Mn2+,其使用的适宜pH范围是C.A.1.0~2.0 B.2.0~2.5 C.3.0~3.5 D 4.0~4.5
(5)取部分加入萃取剂后的混合液,在实验室按流程图获得粗产品.
①使用分液漏斗前要检漏,是检查玻璃塞、旋塞芯是否漏水,若发现其中一处漏水,必要的操作或做法是若发现玻璃塞处漏水,更换分液漏斗,若发现旋塞芯处漏水,则用纸或干布擦净旋塞或旋塞孔,在旋塞芯上涂一层薄薄的润滑脂,将旋塞芯塞进旋塞内,旋转数圈,使润滑脂均匀分布后将旋塞关闭好.(只写出其中一种漏水对应的操作或做法)
②在蒸发过程中为防止产生杂质或脱水,当较多晶体析出时,改为抽滤得到晶体.
写出抽滤装置(如图2)中指定仪器的名称:A安全瓶,B抽气泵.
下列抽滤操作或说法正确的是ABE
A.用蒸馏水润湿滤纸,微开水龙头,抽气使滤纸紧贴在漏斗瓷板上
B.用倾析法转移溶液,开大水龙头,待溶液快流尽时再转移沉淀

C.注意吸滤瓶内液面高度,当接近支管口位置时,拨掉橡皮管,滤液从支管口倒出
D.用抽滤洗涤沉淀时,应开大水龙头,使洗涤剂快速通过沉淀物,以减少沉淀物损失
E.抽滤不宜用于过滤胶状或颗粒太小的沉淀
用少量蒸馏水洗涤晶体,判断晶体是否洗净的具体操作是用洁净的铂丝蘸取最后一次洗涤液在酒精灯火焰上灼烧,如果看到黄色火焰,说明没有洗净,否则已洗净.
 (1)从含碘的有机溶液中提取碘和回收有机溶剂,需要经过蒸馏,指出下面蒸馏装置图中的错误之处.
(1)从含碘的有机溶液中提取碘和回收有机溶剂,需要经过蒸馏,指出下面蒸馏装置图中的错误之处.