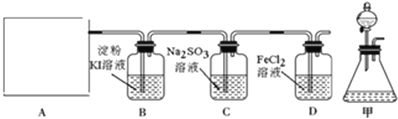
题目内容
【题目】硫有多种含氧酸,在工业上有广泛的应用,其钠盐同样也是重要的化工产品。
Ⅰ.硫代硫酸钠( Na2S2O3)可用做分析试剂及鞣革还原剂。它受热、遇酸易分解。工业上常利用含硫废水生产Na2S2O3·5H2O,实验室可用如下装置模拟生成过程:
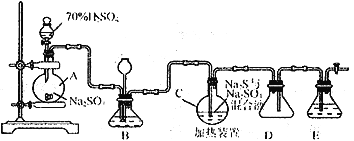
烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)==NaSO3(aq)+H2S(aq)(Ⅰ)
2H2S(aq)+SO2(g)=3S(s)+2H2O(l)(Ⅱ)
S(s)+Na2SO3(aq) ![]() Na2S2O3(aq)(Ⅲ)
Na2S2O3(aq)(Ⅲ)
(1)烧瓶A中发生反应的离子方程式为_________________________________。装置D的作用是__________________________。
(2)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择_____________。
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
(3)反应后期可用酒精灯适当加热烧瓶A,实验室用酒精灯加热时必须使用石棉网的仪器还有______
a.烧杯 b.燕发皿 c.试管 d.锥形瓶
(4)为了保证Na2S2O3的产量,实验中通入SO2不能过量,原因是_____________________。
Ⅱ.焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。(Na2S2O5溶于水即生成NaHSO3。
(5)证明NaHSO3溶液中HSO3-电离程度大于水解程度,可采用的实验方法有________________。
a.测定溶液的pH b.加入Ba(OH)2溶液 c. .加入盐酸
d.加入品红溶液 e.用蓝色石蕊试纸检测
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定菜葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI):
![]()
①按上述方案实验,消耗标准I2溶液25.00mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为______g/L
②在上述实验过程中,HI可能会被空气氧化,反应的化学方程式为_____________________________。若有部分HI被空气氧化,会导致测得的结果_______(填“偏高”“ 偏低”或“不变”)。
【答案】 SO32-+2H+=H2O+SO2↑ 防止倒吸 c ad 若SO2过量,溶液显酸性,产物分解 ae 0.16 4HI+O2=2I2+2H2O 偏低
【解析】(1)烧瓶A中亚硫酸钠与硫酸反应生成二氧化硫、硫酸钠和水,其反应的离子方程式为:SO32-+2H+=H2O+SO2↑;D中左侧为短导管可防止液体倒吸,故答案为:SO32-+2H+=H2O+SO2↑;防止倒吸;
(2)观察SO2的生成速率,是通过观察溶液中产生气泡的快慢来判断,所以溶液不能与SO2反应,选项中只有饱和NaHSO3溶液与二氧化硫不反应,故答案为:c;
(3)体积较大的玻璃仪器在加热时,仪器下面要放石棉网,防止仪器受热不均而炸裂,其中烧杯、锥形瓶加热时必须使用石棉网,故答案为:ad;
(4)由题目信息可知,硫代硫酸钠(Na2S2O3)遇酸易分解,若二氧化硫过量会使溶液呈酸性,硫代硫酸钠会分解,故答案为:若SO2过量,溶液显酸性,产物分解;
(5)NaHSO3溶液中HSO3-的电离程度大于水解程度,溶液呈酸性,测定溶液的pH,可以确定溶液酸碱性,酸性溶液可以使湿润蓝色石蕊试纸变红,所以能用测定溶液pH值、湿润的蓝色石蕊试液检验,而加入Ba(OH)2溶液、HCl溶液、品红溶液都不能说明溶液呈酸性,故选ae,故答案为:ae;
(6)令100mL葡萄酒中二氧化硫的质量为mg,则:
SO2+2H2O+I2═H2SO4+2HI
64g 1mol
mg 0.025L×0.01mol/L
所以![]() =
=![]() ,解得m=0.016,故该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为
,解得m=0.016,故该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为![]() =0.16 g/L,若有部分HI被空气氧化,则消耗碘的量偏小,故测定二氧化硫的量偏小,则测定结果偏低;HI与氧气反应的化学方程式为:4HI+O2=2I2+2H2O,故答案为:0.16;偏低;4HI+O2=2I2+2H2O。
=0.16 g/L,若有部分HI被空气氧化,则消耗碘的量偏小,故测定二氧化硫的量偏小,则测定结果偏低;HI与氧气反应的化学方程式为:4HI+O2=2I2+2H2O,故答案为:0.16;偏低;4HI+O2=2I2+2H2O。

 天天向上口算本系列答案
天天向上口算本系列答案【题目】(题文)I. 我们已经学习了同位素、同系物、同素异形体、同分异构体,下面列出了几组物质,请用物质的组号填写下表:
有下列各组物质:
A.O2和O3(臭氧) B.12C和13C C.CH3CH2CH2CH3和CH3CH(CH3)2
D. CH4和C6H14 E.  和
和  F. H+和D+
F. H+和D+
类别 | 同位素 | 同系物 | 同素异形体 | 同分异构体 |
组号 | _______ | _______ | _______ | _______ |
Ⅱ.下图为四种烃的球棍模型,按要求填空

(1)等质量的以上四种烃完全燃烧,消耗O2最多的是_______(填字母序号)
(2)能说明D分子中的碳碳键不是单双键交替的事实是_________(填序号)
①D不能使酸性KMmO4溶液褪色 ②D中碳碳键的键长键能都相等
③邻二元取代产物只有一种 ④间二元取代只有一种
⑤在一定条件下D与H2发生加成反应生成环已烷
Ⅲ.按要求完成下列问题:
(1)丙烯通入到溴的四氯化碳溶液中的化学方程式:_________。
(2)戊烷的某种同分异构体的一氯代物只有一种,其结构简式为_____________。
(3)用系统命名法给下列有机物命名:
① ____________。
____________。
② ________。
________。
【题目】利用熔融碱焙烧工艺可从铝热法生产金属铬的铬渣(Al、Al2O3、Cr2O3等)中浸出铬和铝,为实现铬和铝的再生利用。其工作流程如下:

(1)铝热法冶炼金属铬,是利用了金属铝的__________(填“氧化性”或“还原性”)。
(2)溶液1中的阴离子有CrO42-、__________。
(3)过程I,在Cr2O3参与的反应中,若生成0.4molCrO42-,消耗氧化剂的物质的量是__________。
(4)通入CO2调节溶液pH实现物质的分离。
①滤渣A煅烧得到Al2O3,再用电解法冶炼Al。冶炼Al的化学方程式是____________________。
②滤渣B受热分解所得物质的循环利用,B是__________。
③已知:2CrO42-+2H+![]() Cr2O72-+H2O K=4.0×1014
Cr2O72-+H2O K=4.0×1014
滤液3中Cr2O72-的溶度是0.04mol/L,则CrO42-的浓度是__________mol/L。
(5)过程II的目的是得到K2Cr2O7粗品。不同温度下化合物的溶解度(g/100gH2O)
化合物名称 | 0℃ | 20℃ | 40℃ | 60℃ | 80℃ |
NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 |
KCl | 28.0 | 34.2 | 40.1 | 45.8 | 51.3 |
K2SO4 | 7.4 | 11.1 | 14.8 | 18.2 | 21.4 |
K2Cr2O7 | 4.7 | 12.3 | 26.3 | 45.6 | 73.0 |
Na2Cr2O7 | 163 | 183 | 215 | 269 | 376 |
结合表中数据分析,过程II的操作是:____________________,过滤,得到K2Cr2O7粗品。