题目内容
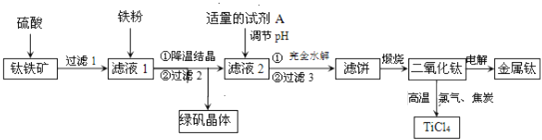
【题目】为了实现资源利用最大化,某化工厂将合成氨、制纯碱和生产尿素![]() 工艺联合,简易流程如下:
工艺联合,简易流程如下:
![]() 时101kPa时,测得生成17g
时101kPa时,测得生成17g![]() ,放出
,放出![]() 热量,写出合成
热量,写出合成![]() 的热化学方程式 ______ .
的热化学方程式 ______ .
![]() 合成氨原料气中的杂质硫化氢用稀氨水吸收,副产品是酸式盐.该副产品的化学式为 ______ .
合成氨原料气中的杂质硫化氢用稀氨水吸收,副产品是酸式盐.该副产品的化学式为 ______ .
![]() 反应器2分离出来的氮气和氢气再通入反应器1,其目的是 ______
反应器2分离出来的氮气和氢气再通入反应器1,其目的是 ______ ![]() 向反应器3充入原料的顺序是:先加氯化钠溶液,通入氨气至饱和,再通入足量的二氧化碳可制得
向反应器3充入原料的顺序是:先加氯化钠溶液,通入氨气至饱和,再通入足量的二氧化碳可制得![]() 反应器3中的化学方程式为 ______ .
反应器3中的化学方程式为 ______ .
![]() 工业上可用碳、甲烷与水蒸汽反应制氢气
工业上可用碳、甲烷与水蒸汽反应制氢气
![]() ,
,![]() ,此反应的化学平衡常数表达式为
,此反应的化学平衡常数表达式为![]() ______ ,为了提高碳的转化率,宜采用下列措施中的
______ ,为了提高碳的转化率,宜采用下列措施中的![]() 填字母编号
填字母编号![]() ______ .
______ .
A.增大压强![]() 增加碳的量
增加碳的量![]() 升高温度
升高温度![]() 增加水的量
增加水的量![]() 使用催化剂
使用催化剂![]() 及时移出CO、
及时移出CO、![]()
![]() 有些国家水电丰富,采用惰性电极电解硫酸钠溶液制氢气,电解时阳极上的电极反应式为 ______ .
有些国家水电丰富,采用惰性电极电解硫酸钠溶液制氢气,电解时阳极上的电极反应式为 ______ .
![]() 若仅以
若仅以![]() 、空气、
、空气、![]() 为原料制尿素
为原料制尿素 ,标准状况下
,标准状况下![]()
![]() ,理论上最多能制 ______
,理论上最多能制 ______ ![]() 尿素.
尿素.
【答案】![]()
![]() 提高原料利用率
提高原料利用率 ![]()
![]() CDF
CDF ![]() 60
60
【解析】
![]() 和
和![]() 完全反应生成17g即
完全反应生成17g即![]() 放热
放热![]() 热量,生成2mol氨气放热
热量,生成2mol氨气放热![]() ,反应为放热反应,反应的焓变为
,反应为放热反应,反应的焓变为![]() ,依据热化学方程式书写得到;
,依据热化学方程式书写得到;
![]() 硫化氢与氨水反应生成
硫化氢与氨水反应生成![]() ;
;
![]() 氮气和氢气再通入反应器1可节约燃料;氯化钠、氨气和二氧化碳可反应生成碳酸氢钠和氯化铵;
氮气和氢气再通入反应器1可节约燃料;氯化钠、氨气和二氧化碳可反应生成碳酸氢钠和氯化铵;
![]() 平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积;为提高某一反应物的转化率,应使平衡向正反应反应方向移动;
平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积;为提高某一反应物的转化率,应使平衡向正反应反应方向移动;
![]() 电解硫酸钠溶液实质是电解水;
电解硫酸钠溶液实质是电解水;
![]() 由C原子守恒可知,
由C原子守恒可知,![]() ,以此计算.
,以此计算.
![]() 和
和![]() 完全反应生成17g即
完全反应生成17g即![]() 放热
放热![]() 热量,生成2mol氨气放热
热量,生成2mol氨气放热![]() ,反应为放热反应,反应的焓变为
,反应为放热反应,反应的焓变为![]() ,反应的热化学方程式为:
,反应的热化学方程式为:![]() ;
;
故答案为:![]() ;
;
![]() 硫化氢与氨水反应生成
硫化氢与氨水反应生成![]() ,故答案为:
,故答案为:![]() ;
;
![]() 氮气和氢气再通入反应器1可节约燃料,提高原料利用率;氯化钠、氨气和二氧化碳可反应生成碳酸氢钠和氯化铵:
氮气和氢气再通入反应器1可节约燃料,提高原料利用率;氯化钠、氨气和二氧化碳可反应生成碳酸氢钠和氯化铵:![]() ,
,
故答案为:提高原料利用率;![]() ;
;
![]() 平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积积,所以
平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积积,所以![]() ;为提高碳的转化率,应是反应向正反应方向移动,则可采取的措施有:升高温度、增加水的量、及时分离出CO、
;为提高碳的转化率,应是反应向正反应方向移动,则可采取的措施有:升高温度、增加水的量、及时分离出CO、![]() ,
,
故答案为:![]() ;CDF;
;CDF;
![]() 电解硫酸钠溶液实质是电解水,阳极反应式为
电解硫酸钠溶液实质是电解水,阳极反应式为![]() ,故答案为:
,故答案为:![]() ;
;
![]() 的物质的量是1000mol,由C原子守恒可知,
的物质的量是1000mol,由C原子守恒可知,![]() ,
,![]() 的物质的量是1000mol,质量60000g,即60kg,故答案为:60.
的物质的量是1000mol,质量60000g,即60kg,故答案为:60.

 名校课堂系列答案
名校课堂系列答案【题目】下列有关实验现象和解释或结论都正确的是
选项 | 实验操作 | 现象 | 解释或结论 |
A | 向淀粉的酸性水解液中滴入少量新制Cu(OH)2悬浊液并加热 | 有砖红色沉淀生成 | 葡萄糖具有还原性 |
B | NaAlO2溶液与NaHCO3溶液混合 | 白色絮状沉淀生成 | 二者水解相互促进生成氢氧化铝沉淀 |
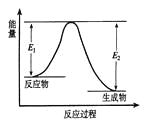
C | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 反应2NO2 的△H<0 |
D | 向盛有1mL0.l mol/L的AgNO3溶液中加入10滴0.1mol/L的NaCl溶液,振荡,再加入10滴0.1mol/L的NaI溶液,再振荡 | 先生成白色沉淀,后产生黄色沉淀 | Ksp(AgI)sp(AgCl) |
A. A B. B C. C D. D