题目内容
如图表示一定条件下,A、B、C三种气体物质的量浓度随时间变化的情形.(1)该反应的反应物是 .
(2)该反应的化学方程式为 .
(3)在0~2min,该反应用A表示的平均反应速率为 .

【答案】分析:(1)根据图象中A、B、C浓度的变化趋势判断反应物和生成物;
(2)判断出反应物和生成物,根据浓度变化之比等于化学剂量数之比确定反应的化学方程式;
(3)根据v=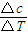 计算反应速率.
计算反应速率.
解答:解:(1)由图象可知,在反应中,A的浓度逐渐减小,B、C的浓度逐渐增大,则A为反应物,B、C为生成物,故答案为:A;
(2)A为反应物,B、C为生成物,相同时间内浓度的变化比值为c(A):c(B):c(C)=(1.0-0.2):0.4:1.2=2:1:3,
化学反应中浓度变化之比等于化学剂量数之比,则化学方程式为2A B+3C,故答案为:2A
B+3C,故答案为:2A B+3C;
B+3C;
(3)在0~2min,该反应用A表示的平均反应速率为:v=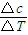 =
=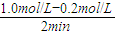 =0.4mol?L-1?min-1,故答案为:0.4mol?L-1?min-1.
=0.4mol?L-1?min-1,故答案为:0.4mol?L-1?min-1.
点评:本题考查化学平衡的图象问题,题目难度不大,注意化学方程式的确定方法反应速率计算公式的运用.
(2)判断出反应物和生成物,根据浓度变化之比等于化学剂量数之比确定反应的化学方程式;
(3)根据v=
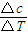 计算反应速率.
计算反应速率.解答:解:(1)由图象可知,在反应中,A的浓度逐渐减小,B、C的浓度逐渐增大,则A为反应物,B、C为生成物,故答案为:A;
(2)A为反应物,B、C为生成物,相同时间内浓度的变化比值为c(A):c(B):c(C)=(1.0-0.2):0.4:1.2=2:1:3,
化学反应中浓度变化之比等于化学剂量数之比,则化学方程式为2A
 B+3C,故答案为:2A
B+3C,故答案为:2A B+3C;
B+3C;(3)在0~2min,该反应用A表示的平均反应速率为:v=
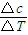 =
=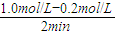 =0.4mol?L-1?min-1,故答案为:0.4mol?L-1?min-1.
=0.4mol?L-1?min-1,故答案为:0.4mol?L-1?min-1.点评:本题考查化学平衡的图象问题,题目难度不大,注意化学方程式的确定方法反应速率计算公式的运用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 如图表示一定条件下,A、B、C三种气体物质的量浓度随时间变化的情形.
如图表示一定条件下,A、B、C三种气体物质的量浓度随时间变化的情形. B+3C
B+3C
 有如下化学反应:2A(g)+B(g)?2C(g),△H<0.
有如下化学反应:2A(g)+B(g)?2C(g),△H<0.