题目内容
(B类)某溶液中仅含有Na+、Mg2+、S
、Cl-四种离子,其物质的量浓度之比为Na+:Mg2+:Cl-=3:5:5,若Na+浓度为3mol/L,则S
的浓度为( )
| O | 2- 4 |
| O | 2- 4 |
分析:根据钠离子的浓度,由离子浓度比例关系计算镁离子、氯离子的浓度,根据溶液电荷守恒有c(Na+)+2c(Mg2+)=c(Cl-)+2c(SO42-),据此计算.
解答:解:Na+浓度为3mol/L,由c(Na+):c(Mg2+):c(Cl-)=3:5:5,可得c(Mg2+)=5mol/L,c(Cl-)=5mol/L,
根据溶液电荷守恒有c(Na+)+2c(Mg2+)=c(Cl-)+2c(SO42-),故:
3mol/L+2×5mol/L=5mol/L+2c(SO42-)
解得:c(SO42-)=4mol/L,
故选C.
根据溶液电荷守恒有c(Na+)+2c(Mg2+)=c(Cl-)+2c(SO42-),故:
3mol/L+2×5mol/L=5mol/L+2c(SO42-)
解得:c(SO42-)=4mol/L,
故选C.
点评:本题考查物质的量浓度的有关计算,难度中等,注意混合溶液中离子浓度的计算常利用电荷守恒计算.

练习册系列答案
相关题目
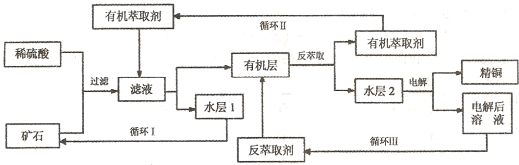
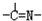 三种基团,无环状结构,三种基团的数目关系为n3=
三种基团,无环状结构,三种基团的数目关系为n3=

 三种基团,无环状结构,三种基团的数目关系为n3=
三种基团,无环状结构,三种基团的数目关系为n3=
 三种基团,无环状结构,三种基团的数目关系为n3=______.若A的相对分子质量为116,分子结构中碳原子跟碳原子相连接,则A的结构简式是______.
三种基团,无环状结构,三种基团的数目关系为n3=______.若A的相对分子质量为116,分子结构中碳原子跟碳原子相连接,则A的结构简式是______.


 三种基团,无环状结构,三种基团的数目关系为n3=______.若A的相对分子质量为116,分子结构中碳原子跟碳原子相连接,则A的结构简式是______.
三种基团,无环状结构,三种基团的数目关系为n3=______.若A的相对分子质量为116,分子结构中碳原子跟碳原子相连接,则A的结构简式是______.