题目内容
如图所示,通电5 min后,第③极增重2.16 g,同时在A池中收集到标准状况下的气体224 mL,设A池中原混合液的体积为200 mL,求通电前A池中原混合溶液Cu2+的浓度.

答案:
解析:
解析:
|
答:通电前A池中原混合溶液Cu2+的浓度为0.025 mol/L. 解:在A池中发生的反应为: 阳极(②极):4OH--4e-=2H2O+O2↑ 阴极(①极):2Cu2++4e-=2Cu 若Cu2+完全放电后还有:4H++4e-=2H2↑ 转移电子的物质的量为:2.16÷108=0.02(mol) 由电极反应可知,每转移4 mol电子,放出1 mol O2,所以②极上析出O2的体积为: 0.02÷4×22.4=0.112(L)<0.224(L) 说明A池收集到的气体中还有H2.①极上放出H2为:0.224-0.112=0.112(L),即0.005 mol. ①极上析出Cu和放出H2共获得0.02 mol电子. Cu2+的物质的量为:(0.02-0.005×2)/2=0.005(mol)[Cu2+]=0.005/0.2=0.025(mol/L) |

练习册系列答案
相关题目
 目前流通的第五套人民币硬币材料分别为:1元硬币为铜芯镀镍合金,5角硬币为铜芯镀铜合金,1角硬币为硬铝合金.请回答:(题目中的百分含量均为质量分数)
目前流通的第五套人民币硬币材料分别为:1元硬币为铜芯镀镍合金,5角硬币为铜芯镀铜合金,1角硬币为硬铝合金.请回答:(题目中的百分含量均为质量分数)(1)钢是含碳量为0.03%~2%的
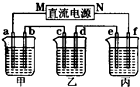
(2)如图所示的装置中,甲、乙、丙三个烧杯分别盛放足量的溶液,电极及溶液如下表所示:
| 电极 | a | b | c | d | e | f |
| 石墨 | 石墨 | 铜 | 钢 | 钢 | 铜 | |
| 溶液 | NaCl溶液 | CuSO4溶液 | CuSO4溶液 | |||
①上述装置中M极为直流电源的
②若在钢币上镀铜,应选择
(3)工业上以铝土矿(主要成分Al2O3?nH2O,含少量的氧化铁和石英等杂质)为原料生产铝.为除去铝土矿样品中氧化铁和石英杂质,要将粉碎、筛选后的铝土矿样品溶解在足量的氢氧化钠溶液中处理,请写出有关反应的离子方程式
(4)已知硬铝中含Cu:2.2%~5%、Mg:0.2%~3%、Mn:0.3%~1.5%、Si:0.5%,其余是Al.1角硬币单枚质量为2.20克,若想制得1角硬币1百万枚,理论上至少需要含Al2O3 90%的铝土矿约



