ћвƒњƒЏ»Ё
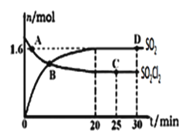
°Њћвƒњ°њЅтЇЌЈ∞µƒѕаєЎїѓЇѕќп£ђ‘Џ“©ќпїѓ—ІЉ∞іяїѓїѓ—Іµ»Ѕм”т”¶”√єгЈЇ°£їЎірѕ¬Ѕ–ќ ћв£Ї
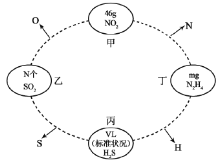
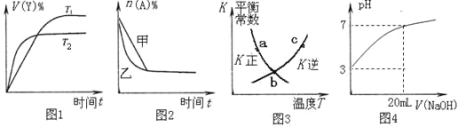
(1)їщћђЈ∞‘≠„”µƒЌвќІµз„”≈≈≤Љ љќ™_________________°£Ј∞”–£Ђ2°Ґ£Ђ3°Ґ£Ђ4°Ґ£Ђ5µ»ґа÷÷їѓЇѕЉџ£ђ∆д÷–„оќ»ґ®µƒїѓЇѕЉџ «______________£ђVO43-µƒЅҐћеєє–Ќќ™__________°£
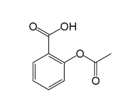
(2)2-џѕїщ—ћЋб—хЈ∞≈дЇѕќп(ЌЉ1) «Є±„ч”√љѕ–°µƒ”––ІµчљЏ—™ћ«µƒ–¬–Ќ“©ќп°£
ҐўЄ√“©ќп÷–N‘≠„”µƒ‘”їѓЈљ љ «____________£ђ∆дЋщЇђµЏґю÷№∆Џ‘™ЋЎµЏ“їµзјлƒ№∞і”…іуµљ–°Ћ≥–тµƒ≈≈Ѕ– «__________________°£
ҐЏ2-џѕїщ—ћЋб(ЌЉ2)ЋЃ»№–‘”≈”Џ2- иїщ—ћЋб—хЈ∞≈дЇѕќпµƒ‘≠“т «_________________________________°£
(3)ґа‘≠„”Ј÷„”÷–Єч‘≠„”»ф‘ЏЌђ“ї∆љ√ж£ђ«“”–ѕаї•∆љ––µƒpємµј£ђ‘тpµз„”њ…‘ЏґаЄц‘≠„”Љд‘Ћґѓ£ђ–ќ≥…°∞јл”т¶–Љь°±£ђѕ¬Ѕ–ќп÷ ÷–іж‘Џ°∞јл”т¶–Љь°±µƒ «________°£
A£ЃSO2°°°°°°B£ЃSO42-°°°°°°C£ЃH2S°°°°°°D£ЃCS2
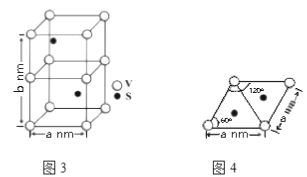
(4)ƒ≥ЅщЈљЅтЈ∞їѓЇѕќпЊІћеµƒЊІ∞ы»зЌЉ3Ћщ Њ£ђЌЉ4ќ™Є√ЊІ∞ыµƒЄ© ”ЌЉ£ђЄ√ЊІ∞ыµƒ√№ґ»ќ™________________ g°§cm£≠3(Ѕ–≥цЉ∆Ћг љЉіњ…)°£
°Њір∞Є°њ3d34s2 +5 ’эЋƒ√жће sp2 N>O>C 2џѕїщњ…“‘”лЋЃЈ÷„”–ќ≥…«вЉь£ђЋщ“‘∆дЋЃ»№–‘їбЄьЇ√ AD 
°Њљвќц°њ
£®1£©Ј∞‘≠„”ќ™23Ї≈‘™ЋЎ£ђЌвќІµз„”≈≈≤Љ љќ™3d34s2£ї∆д„оќ»ґ®µƒїѓЇѕЉџ”¶ «+5£ђЉі І»•Ћщ”–µƒЉџµз„”£ђ–ќ≥…„оЌв≤г8µз„”µƒќ»ґ®љбєє°£ЄщЊЁЉџ≤гµз„”ґ‘ї•≥в‘≠јн£ђVO43-÷–µƒ÷––ƒ‘≠„”VµƒЉџµз„”ќ™5£ђњ…“‘Ћг≥цЉџ≤гµз„”ґ‘ эќ™4£ђЋщ“‘њ’Љдєє–Ќќ™’эЋƒ√жће£ї
£®2£©ҐўN‘≠„”‘ЏяЅа§їЈ÷–£ђяЅа§їЈјаЋ∆”Џ±љїЈµƒљбєє£ђє N‘≠„”ќ™sp2‘”їѓ£ї∆д÷–Їђ”–µƒµЏґю÷№∆Џ‘™ЋЎ «C°ҐN°ҐO°£Ќђ÷№∆Џ‘™ЋЎі”„уѕт”“µЏ“їµзјлƒ№‘ціу£ђµЂNµƒ2pƒ№Љґ…ѕ”–3Єцµз„”£ђіпµљ∞л¬ъќ»ґ®љбєє£ђЋщ“‘NµЏ“їµзјлƒ№Јі≥£‘ціу£ђµЏ“їµзјлƒ№іу–°ќ™£ЇN>O>C°£
ҐЏ2-џѕїщ—ћЋб”–ф»їщњ…“‘”лЋЃЈ÷„”–ќ≥…«вЉь£ђЈ÷„”Љд„ч”√Ѕ¶‘ціу£ђЋщ“‘∆дЋЃ»№–‘їбЄьЇ√£ї
£®3£©і”ћвƒњ±н цјіњі£ђ–ќ≥…јл”т¶–Љьµƒ“™«у «£ЇҐў‘≠„”є≤∆љ√ж£їҐЏ”–ѕаї•∆љ––µƒpємµј°£ЄщЊЁЉџ≤гµз„”ґ‘ї•≥вјн¬џ£ђ
A£ЃSO2ќ™V–Ќ£ђA’э»Ј£ї
B£ЃSO42-ќ™’эЋƒ√жће£ђ≤їє≤∆љ√ж£ђBѕоінќу£ї
C£ЃH2Sќ™V–Ќ£ђµЂH2SµƒH‘≠„”≤їіж‘Џpємµј£ђ Cінќу£ї
D£ЃCS2ќ™÷±ѕя–Ќ£ђє Dѕо’э»Ј£ї
є —°AD°£
£®4£©ЊІ∞ы÷–VµƒЄц эќ™£Ї ![]() £ђSµƒЄц эќ™£Ї
£ђSµƒЄц эќ™£Ї![]() £ђЉі√њЄцЊІ∞ыЇђ”–2ЄцVS°£ЊІ∞ы÷ Ѕњќ™
£ђЉі√њЄцЊІ∞ыЇђ”–2ЄцVS°£ЊІ∞ы÷ Ѕњќ™![]() £ђЄщЊЁЌЉ4њ…Љ∆Ћг≥цЊІ∞ыµ„√жїэќ™
£ђЄщЊЁЌЉ4њ…Љ∆Ћг≥цЊІ∞ыµ„√жїэќ™![]() £ђЊІ∞ыћеїэќ™
£ђЊІ∞ыћеїэќ™![]() £ђЋщ“‘ЊІ∞ы√№ґ»ќ™
£ђЋщ“‘ЊІ∞ы√№ґ»ќ™![]()
 g°§cm£≠3£ї
g°§cm£≠3£ї

 ‘ƒґЅњм≥µѕµЅ–ір∞Є
‘ƒґЅњм≥µѕµЅ–ір∞Є°Њћвƒњ°њЅтіъЅтЋбƒ∆(Na2S2O3) «÷Ў“™µƒїѓє§‘≠Ѕѕ£ђњ…”√„чЈ÷ќц ‘ЉЅЉ∞чЈЄпµƒїє‘≠ЉЅ£ђ“„»№”ЏЋЃ£ђ №»»°Ґ”цЋб“„Ј÷љв°£Na2S2O3°§5H2O «ќё…ЂЌЄ√чЊІће£ђ“„»№”ЏЋЃ£ђ∆дѕ°»№“Ї”лBaCl2»№“ЇїмЇѕќё≥Ѕµн…ъ≥…°£є§“µ…ѕ≥£јы”√ЇђЅтЈѕЋЃ…ъ≤ъNa2S2O3°§5H2O£ђƒ≥їѓ—І–Ћ»§–°„й‘Џ µ—й “÷–”√»зЌЉЋщ Њ„∞÷√(Љ”»»„∞÷√Љ∞≤њЈ÷Љ–≥÷„∞÷√“—¬‘»•)ƒ£ƒв∆д…ъ≤ъєэ≥ћ≤ҐћљЊњ∆дїѓ—І–‘÷ °£
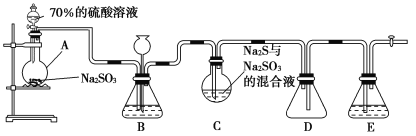
…’∆њC÷–ЈҐ…ъ»зѕ¬Јі”¶£Ї
Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq) Ґў
2H2S(aq)+SO2(g)=3S(s)+2H2O(l) ҐЏ
S(s)+Na2SO3(aq)![]() Na2S2O3(aq) Ґџ
Na2S2O3(aq) Ґџ
Ґс.÷∆±ЄNa2S2O3°§5H2O
(1)Љ”»л“©∆Ј÷Ѓ«∞–лљш––µƒ≤ў„ч «_________£ї„∞÷√Dµƒ„ч”√ «______________£ї„∞÷√Bµƒ„ч”√÷Ѓ“ї «єџ≤мSO2µƒ…ъ≥…Ћў¬ £ђ∆д÷–µƒ ‘ЉЅ„оЇ√—°”√________(ћо„÷ƒЄ)°£
A.’фЅуЋЃ°°°°°°°°°°°°°° B.±•ЇЌNa2SO3»№“Ї
C.±•ЇЌNaHSO3»№“Ї D.±•ЇЌNaHCO3»№“Ї
(2)ќ™±£÷§ЅтіъЅтЋбƒ∆µƒ≤ъЅњ£ђ µ—й÷–≤ъ…ъµƒSO2≤їƒ№єэЅњ£ђ‘≠“т «_________£їЋщ÷∆µ√µƒі÷≤ъ∆Јњ…“‘Ќ®єэ________ЈљЈ®љш“ї≤љћбіњµ√µљіњNa2S2O3°§5H2O°£
Ґт.≤вґ®≤ъ∆Јіњґ»
„Љ»Ј≥∆»°w g≤ъ∆Ј£ђ”√ Ѕњ’фЅуЋЃ»№љв£ђ“‘µнЈџ„ч÷Є ЊЉЅ£ђ”√0.10 mol°§L£≠1I2µƒ±к„Љ»№“Їµќґ®°£Јі”¶‘≠јнќ™2S2O32-+I2=S4O62-+2I-°£
(3)µќґ®÷Ѕ÷’µг ±µƒѕ÷ѕу£Ї______________°£µќґ®∆р ЉЇЌ÷’µг ±I2µƒ±к„Љ»№“Ї“Ї√жќї÷√»зЌЉЋщ Њ£ђ‘тѕыЇƒI2µƒ±к„Љ»№“Їµƒћеїэќ™________mL°£≤ъ∆Јµƒіњґ»ќ™________(…иNa2S2O3°§5H2Oµƒѕаґ‘Ј÷„”÷ Ѕњќ™M£ђЅ–≥ц”√M°Ґw±н Њµƒ±ніп љ)°£
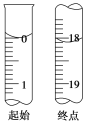
Ґу.ћљЊњNa2S2O3µƒ≤њЈ÷їѓ—І–‘÷
(4)£®ћб≥цЉў…и£©°°
Љў…и“ї£ЇNa2S2O3”лNa2SO4µƒљбєєѕаЋ∆£ђїѓ—І–‘÷ “≤”¶Є√ѕаЋ∆£ђ“тіЋ£ђ “ќ¬ ±Na2S2O3»№“ЇµƒpH=7°£
Љў…иґю£Їі”SµƒїѓЇѕЉџЌ∆≤вNa2S2O3Њя”–љѕ«њµƒїє‘≠–‘°£
£®—й÷§Љў…и£©°°≈д÷∆ ЅњNa2S2O3»№“Ї£ђљш––»зѕ¬ µ—й£ђ«лљЂ µ—й≤є≥дЌк’ы°£
µ—й≤ў„ч | µ—йљб¬џ їтѕ÷ѕу | ѕ÷ѕуљв Ќ(”√јл„” Јљ≥ћ љ±н Њ) | |
Љў…и“ї | ________ | »№“ЇpH=8 | ________ |
Љў…иґю | ѕтдеЋЃ÷– µќ»л Ѕњ Na2S2O3 »№“Ї | деЋЃЌ …Ђ | ________ |
µ—йљб¬џ£Ї________________________________________°£
Ґф.Na2S2O3µƒ”¶”√
(5)Na2S2O3µƒ…ћ∆Ј√ыќ™°∞Ї£≤®°±£ђЋ„≥∆°∞іуЋ’іт°±£ђїѓ—І…ѕ≥£”√”Џµќґ® µ—й°£ќ™≤вґ®ƒ≥K2Cr2O7»№“Їµƒ≈®ґ»£ђ—–Њњ–°„йµƒЌђ—І„Љ»ЈЅњ»°10.00 mL K2Cr2O7»№“Ї”Џ„ґ–ќ∆њ÷–£ђЉ”»лєэЅњKIєћћеЇЌ Ѕњѕ°H2SO4£ђµќЉ”ЉЄµќ÷Є ЊЉЅ£ђ”√0.10 mol°§L£≠1 Na2S2O3±к„Љ»№“Їµќґ®÷Ѕ÷’µг£ђљш––3іќ∆љ–– µ—йЇу£ђ≤вµ√∆љЊщѕыЇƒNa2S2O3»№“Їµƒћеїэќ™30.00 mL£ђ‘тc(K2Cr2O7)=________mol°§L£≠1°£(“—÷™£ЇCr2O72-+6I-+14H£Ђ=2Cr3++3I2+7H2O£ђ2S2O32-+I2=S4O62-+2I-)
Ґх.ћљЊњ”лЈіЋЉ
(6)ќ™—й÷§≤ъ∆Ј÷–Їђ”–Na2SO3ЇЌNa2SO4£ђЄ√–°„й…иЉ∆ЅЋ“‘ѕ¬ µ—йЈљ∞Є£ђ«лљЂ µ—йЈљ∞Є≤є≥дЌк’ы°£
»° Ѕњ≤ъ∆Ј≈д≥…ѕ°»№“Ї£ђ___________________(Ћщ–и ‘ЉЅі”BaCl2»№“Ї°Ґѕ°HNO3°Ґѕ°H2SO4°Ґѕ°—ќЋб°Ґ’фЅуЋЃ÷–—°‘с)°£
°Њћвƒњ°њѕ¬Ѕ– µ—й°Ґѕ÷ѕуЉ∞ѕаєЎљб¬џЊщ’э»Јµƒ «
A | B | C | D | |
µ—й |
|
|
|
|
ѕ÷ѕу | ∆ЈЇмЌ …Ђ | „оЇу ‘є№”–«≥ї∆…Ђ≥Ѕµн | „оЇу“їµќ»№“Ї єЈ”ћ™”…ќё…Ђ±дќ™ЈџЇм…Ђ£ђ«“30s≤їЄі‘≠ | ≥цѕ÷∞„…Ђ≥Ѕµн |
љб¬џ | SO2 ”–«њ«њ—хїѓ–‘ | ”–їъќп÷–Їђ”–де‘≠„” | µќґ®іп÷’µг | Ksp(AgCl)£ЊKsp(AgI) |
A.AB.BC.CD.D
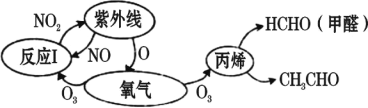
°Њћвƒњ°њ÷№∆Џ±н«∞Ћƒ÷№∆Џµƒ‘™ЋЎa°Ґb°Ґc°Ґd°Ґe£ђ‘≠„”–т э“јіќ‘ціу£ђaЇЌb «„й≥…ќп÷ ÷÷ја„оґаµƒ‘™ЋЎ£ђc «µЎњ«÷–ЇђЅњ„оґаµƒ‘™ЋЎ£ђd”лbЌђ„е£ђe2+јл„”µƒ3dємµј÷–”–9Єцµз„”°£їЎірѕ¬Ѕ–ќ ћв£Ї
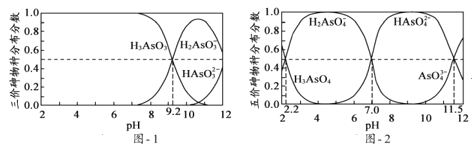
(1)c°ҐdЅљ÷÷‘™ЋЎ–ќ≥…µƒїѓЇѕќпЌ≥≥∆єи ѓ£ђњ…Ќ®єэ______________ЈљЈ®«шЈ÷∆дљбЊІ–ќЇЌќёґ®–ќµƒЅљ÷÷іж‘Џ–ќћђ£ђcµƒЉџµз„”≈≈≤ЉЌЉќ™______________________________°£
(2)AЇЌB «…ъїо÷–Ѕљ÷÷≥£Љыµƒ”–їъќп£ђAƒ№”лCaCO3Јі”¶£ђњ…”√”Џ≥шЈњ≥эЋЃєЄ£їBЈ÷„”÷–µƒћЉ‘≠„” эƒњ”лA÷–ѕаЌђ£ђњ…”лƒ∆Јі”¶Ј≈≥ц∆шће°£B÷–іж‘Џµƒїѓ—ІЉьја–Ќ «______£ї
A.јл„”Љь B.є≤ЉџЉь C.љр фЉь D.«вЉь
AЈ÷„”÷–ћЉ‘≠„”µƒємµј‘”їѓја–Ќ «___________°£
(3)”√°∞>°±їт°∞<°±ћоњ’£Ї
µЏ“їµзјлƒ№ | »џµг |
b___d | dc2ЊІће___dЊІће |
(4)c”лeЅљ÷÷‘™ЋЎњ…–ќ≥…“ї÷÷∞лµЉће≤ƒЅѕ£ђїѓ—І љќ™e2c£ђ‘Џ∆дЅҐЈљЊІ∞ыƒЏ≤њ”–ЋƒЄцc‘≠„”£ђ∆д”аc‘≠„”ќї”Џ√ж–ƒЇЌґ•µг£ђ‘тЄ√ЊІ∞ы÷–”–____Єцe‘≠„”°£
(5)ѕтe2+ЅтЋб—ќµƒЋЃ»№“Ї÷–Љ”»лєэЅњµƒ∞±ЋЃ£ђњ…µ√µљ…ојґ…ЂЌЄ√ч»№“Ї£ђ–і≥ц…ъ≥…≈дјл„”µƒљбєє______________(“™«уї≠≥ц≈дќїЉь)°£