题目内容
【题目】某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验:
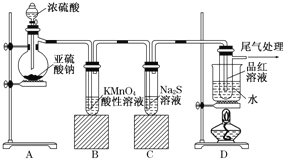
(1)装置A中盛放亚硫酸钠的仪器名称是_________,其中发生反应的化学方程式为_______。
(2)实验过程中,装置B、C中发生的现象分别是______、______,装置B中发生反应的离子方程式为_____。
(3)设计装置D的目的是________。
(4)最后用某溶液进行尾气处理,反应的离子方程式为_________________
【答案】蒸馏烧瓶 Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O 溶液由紫红色变为无色 无色溶液中出现黄色浑浊 5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+ 探究SO2与品红作用的可逆性 SO2+2OH-=SO32-+H2O
【解析】
(1)根据仪器名称书写;亚硫酸钠和浓硫酸反应生成硫酸钠、二氧化硫和水;
(2)二氧化硫能被酸性高锰酸钾氧化,能和硫化氢发生氧化还原反应生成硫单质;根据元素化合价变化判断氧化性、还原性;
(3)因二氧化硫能使品红褪色,但加热褪色后的溶液又可恢复红色,装置D的目的是探究SO2与品红作用的可逆性;
(4)利用氢氧化钠溶液来吸收尾气。
(1)该仪器是蒸馏烧瓶,硫酸的酸性大于亚硫酸,根据强酸制取弱酸知,硫酸和亚硫酸钠反应生成硫酸钠、二氧化硫和水,反应方程式为:Na2SO3+H2SO4(浓)═Na2SO4+SO2↑+H2O,故答案为:蒸馏烧瓶;Na2SO3+H2SO4(浓)═Na2SO4+SO2↑+H2O。
(2)酸性高锰酸钾具有强氧化性,通入二氧化硫后溶液褪色,说明高锰酸钾将二氧化硫氧化,自身被还原,所以二氧化硫具有还原性,看到的现象是溶液由紫色变为无色,反应的离子方程式为:5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+,硫化氢和二氧化硫反应生成硫单质,硫不易溶于水,所以看到无色溶液中出现淡黄色沉淀,故答案为:溶液由紫红色变为无色;无色溶液出现淡黄色浑浊;5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+。
(3)因二氧化硫能使品红褪色,但加热褪色后的溶液又可恢复红色,装置D的目的是探究SO2与品红作用的可逆性,故答案为:探究SO2与品红作用的可逆性。
(4)利用氢氧化钠溶液来吸收尾气,发生的离子反应为:SO2+2OH-=SO32-+H2O,故答案为:SO2+2OH-=SO32-+H2O。

【题目】现有下列短周期元素的数据(已知Be的原子半径为0.089nm):
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
原子半径(nm) | 0.074 | 0.160 | 0.152 | 0.110 | 0.099 | 0.186 | 0.075 | 0.082 |
最高正化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
最低负化合价 | -2 | -3 | -1 | -3 |
(1)⑧号元素在周期表中的位置是______________________________;上述元素处于同一主族的有_______________________________。(用元素号表示)
(2)元素①和⑥能形成两种化合物,其中较稳定的化合物与水反应的离子方程式:_______。
(3)含锂材料在社会中广泛应用,如各种储氢材料(Li2NH等)、便携式电源材料(LiCoO2等);![]() 和
和![]() 作核反应堆最佳热载体,
作核反应堆最佳热载体,![]() H和
H和![]() D用作高温堆减速剂。下列说法中正确的是___________。
D用作高温堆减速剂。下列说法中正确的是___________。
A.![]() 和
和![]() 属于同种核素
属于同种核素
B.![]() H和
H和![]() D的化学性质不同
D的化学性质不同
C.![]() H和
H和![]() D是同种物质
D是同种物质
D.氧化性:Li+<Na+<K+<Rb+<Cs+
E.碱性:Be(OH)2<LiOH<NaOH<KOH
F.半径:K>Na>Li>Li+
(4)胶态磁流体在医学上有重要的用途,而纳米级Fe3O4是磁流体中的重要粒子,其制备过程可简单表示如下:将⑦的最简单的气态氢化物通入到等物质的量的FeSO4、Fe2(SO4)3的混合溶液中,生成两种碱,写出该反应过程中的总离子方程式______________。反应生成的两种碱继续作用即得到产品。