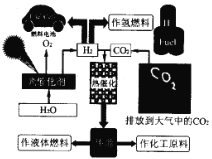
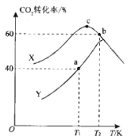
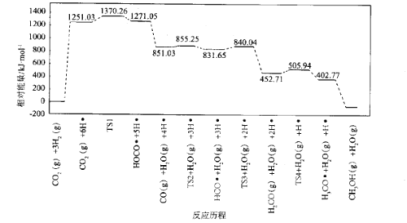
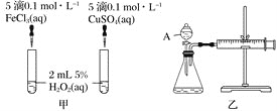
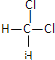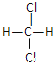题目内容
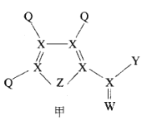
【题目】化合物甲是一种重要的医药中间体,其结构式如图所示。其中Q、W、X、Y、Z为原子半径依次递增的短周期元素,Q、X、Z分列于三个不同周期。下列说法错误的是
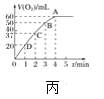
A.非金属性:X<Z<W
B.Q与W形成化合物的沸点高于Q与X形成化合物的沸点
C.化合物甲中除Q外,其它原子均满足8电子稳定结构
D.0.1 molL-1 最高价氧化物对应水化物的酸性:Y> Z
【答案】B
【解析】
由“Q、X、Z分列于三个不同周期”,可推出Q为H元素,X为第二周期元素,Z为第三周期元素;从甲的结构图中可以看出,X形成4个共价键,W形成2个共价键,Z形成2个共价键,则X最外层电子数为4,W最外层电子数为6,Z最外层电子数为6;从而得出X为C元素,W为O元素,Z为S元素。
由以上分析可知,Q、W、X、Y、Z分别为H、O、C、Cl、S。
A.因为酸性H2CO3<H2SO4,所以非金属性C<S,故非金属性:C<S<O,A正确;
B.H与O形成化合物可能为H2O或H2O2,沸点可能低于H与C形成化合物(如高聚物)的沸点,B错误;
C.化合物甲中含有H、C、O、S元素,除H外,其它原子均满足8电子稳定结构,C正确;
D.0.1 molL-1 最高价氧化物对应水化物的酸性:Cl> S,D正确;
故选B。

练习册系列答案
相关题目