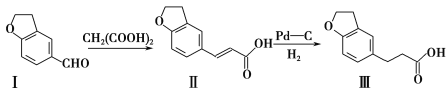
题目内容
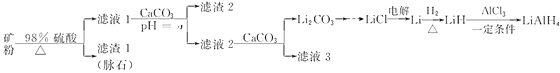
【题目】四氢铝锂(LiAlH4)常作有机合成的重要还原剂。以辉锂矿(主要成分是Li2O·Al2O3·4SiO2,含少量Fe2O3)为原料合成四氢铝锂的流程如下:
已知:①几种金属氢氧化物沉淀的pH如下表所示:
物质 | Fe(OH)3 | Al(OH)3 |
开始沉淀的pH | 2.3 | 4.0 |
完全沉淀的pH | 3.7 | 6.5 |
②常温下,Ksp(Li2CO3)=2.0×10-3,Li2CO3在水中溶解度随着温度升高而减小。
回答下列问题:
(1)上述流程中,提高“酸浸”速率的措施有______________________________________、______________________________________________________________________________(写两条);加入CaCO3的作用是__________________,“a”的最小值为___________。
(2)设计简单方案由Li2CO3制备LiCl:__________。
(3)写出LiH和AlCl3反应的化学方程式为______________________(条件不作要求)。
(4)用热水洗涤Li2CO3固体,而不用冷水洗涤,其目的是________________;检验碳酸锂是否洗净的实验方法是_____________________。
(5)在有机合成中,还原剂的还原能力通常用“有效氢”表示,其含义是1克还原剂相当于多少克氢气的还原能力。LiAlH4的“有效氢”为_________________(结果保留2位小数)。
【答案】粉碎矿石 加热 调节pH使Al3+、Fe3+转化成氢氧化物 6.5 用盐酸溶解,在氯化氢气流中蒸干溶液 AlCl3+4LiH===LiAlH4+3LiCl 减少碳酸锂的损失 取最后一次洗涤液于试管中,滴加氯化钡溶液和稀硝酸(或其他合理答案) 0.21
【解析】
辉锂矿(主要成分是Li2OAl2O34SiO2,含少量Fe2O3)为原料合成四氢铝锂,矿粉中加入浓硫酸然后过滤,得到的滤渣1为脉石,滤液1中含有硫酸铁、硫酸铝、硫酸锂和硫酸,向滤液1中加入碳酸钙,碳酸钙和氢离子反应从而调节溶液的pH,使溶液中铁离子、铝离子转化为沉淀,滤液2中含有硫酸锂和硫酸钙,向滤液2中加入碳酸钙,得到碳酸锂沉淀和滤液3,电解氯化锂得到Li,Li和氢气化合得到LiH,LiH和氯化铝在一定条件下反应生成LiAlH4,据此分析作答。
(1)加硫酸从矿石中浸出,如粉碎矿石、提高硫酸浓度、加热等措施可以提高反应速率。加入碳酸钙中和溶液中的酸,使铁、铝离子完全生成氢氧化铁、氢氧化铝沉淀。
(2)在氯化氢中蒸干氯化锂溶液,类似从海水中提取氯化镁。
(3)氯化铝与氢化锂反应生成四氢铝锂和氯化锂。
(4)依题意,碳酸锂的溶解度随温度升高而减小,用热水洗涤碳酸锂,可以减少碳酸锂损失。沉淀表面有硫酸钠,检验SO42-可判断沉淀是否洗净。
(5)由题给信息可知,还原剂的还原能力实指失电子数。
(1)加硫酸从矿石中浸出,如粉碎矿石、提高硫酸浓度、加热等措施可以提高反应速率。加入碳酸钙中和溶液中的酸,使铁、铝离子完全生成氢氧化铁、氢氧化铝沉淀。从表格信息看,调节pH最小值为6.5,确保铝离子完全沉淀。
(2)在氯化氢中蒸干氯化锂溶液,类似从海水中提取氯化镁。
(3)氯化铝与氢化锂反应生成四氢铝锂和氯化锂,方程式为AlCl3+4LiH===LiAlH4+3LiCl。
(4)依题意,碳酸锂的溶解度随温度升高而减小,用热水洗涤碳酸锂,可以减少碳酸锂损失。沉淀表面有硫酸钠,检验SO42-可判断沉淀是否洗净。检验碳酸锂是否洗净的实验方法:取最后一次洗涤液于试管中,滴加氯化钡溶液和稀硝酸(或其他合理答案)。
(5)由题给信息可知,还原剂的还原能力实指失电子数,1 mol LiAlH4能提供8 mol电子,相当于4 mol H2,LiAlH4的有效氢为8 g/38 g≈0.21。

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案【题目】下表是元素周期表的一部分,针对表中的①~⑧种元素,请按要求填写下列空白:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
2 | ① | ② | ③ | ④ | |||
3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)在元素①②⑤⑥⑦⑧对应的最高价氧化物的水化物中,碱性最强的化合物的电子式是:_________;
(2)写出元素②的最简单氢化物的化学式____________;
(3)④⑤⑥⑦四种元素的简单离子半径从大到小排序____________(用离子符号表示);
(4)写出元素⑥的最高价氧化物与元素⑤的最高价氧化物的水化物反应的离子方程式______________________________________;
(5)写出元素③的常见氢化物和它的最高价氧化物的水化物反应的化学方程式_______________。