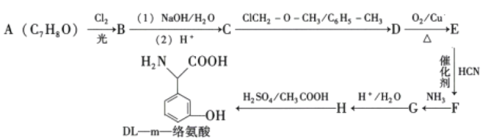
题目内容
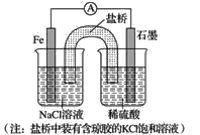
【题目】钢材在社会发展中应用广泛。为研究某种碳素钢(含少量碳和硫)的成分,科研小组进行了如下探究活动:称取碳素钢(已除表面氧化物)97.50 g放入耐高温反应管中与O2反应,除去未反应的O2,收集到干燥混合气体X 1.12 L(已折算成标准状况下的体积)。
(1)碳素钢属于___________材料(填标号)
A.有机高分子材料 B.金属材料 C.无机非金属材料 D.复合材料
(2)科研小组用下图所示实验装置检验混合气体X的组成。
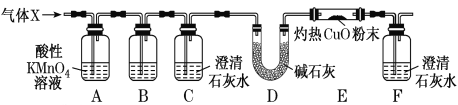
①装置B中的试剂是______________,装置C的作用是______________。
②若观察到_________________(填实验现象),证明X中含有CO。
(3)反应后,耐高温反应管内固体中除含有Fe3+之外,还可能含有Fe2+。要确定其中的Fe2+,可选用________(填序号)。
a.稀H2SO4和KMnO4溶液 b.KSCN溶液和铁粉
c.稀盐酸和K3[Fe(CN)6]溶液 d.KSCN溶液和氯水
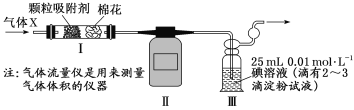
(4)科研小组用下图所示装置(部分)测定SO2的体积分数,并计算碳素钢的含碳量。将气体X 缓慢通过实验装置,当观察到___________________(填实验现象)时,停止通气,此时气体流量仪显示的流量为224 mL(已换算成标准状况下的体积)。装置Ⅲ中的化学反应方程式为________________,碳素钢中碳元素的质量分数为_________(保留1位小数)。
【答案】B 品红溶液 验证X中是否含有CO2 E中黑色固体逐渐变红,F中澄清石灰水变浑浊 ac Ⅲ中溶液由蓝色突变为无色 SO2+I2+2H2O=H2SO4+2HI 0.6%
【解析】
碳素钢是铁合金,属于金属材料,主要成分是Fe,其中含有的杂质主要是C、S将其高温煅烧,Fe变为铁的氧化物,其中的杂质C可能被氧化为CO2、CO,S被氧化产生SO2,用A装置中酸性高锰酸钾溶液氧化SO2产生硫酸除去SO2,再用B的品红溶液来检验SO2是否除净,然后通过装置C检验CO2的产生,然后经过装置D除去未反应的CO2,并对气体进行干燥,利用CO的还原性:CO+CuO![]() CO2+Cu,可根据E装置中固体颜色的变化及F中石灰水检验CO的产生;根据碘单质与SO2的关系式SO2+I2+2H2O=H2SO4+2HI,计算SO2的体积,再根据二氧化硫的体积可计算出一氧化碳和二氧化碳的体积,最后根据碳守恒从而解答碳元素的质量分数。
CO2+Cu,可根据E装置中固体颜色的变化及F中石灰水检验CO的产生;根据碘单质与SO2的关系式SO2+I2+2H2O=H2SO4+2HI,计算SO2的体积,再根据二氧化硫的体积可计算出一氧化碳和二氧化碳的体积,最后根据碳守恒从而解答碳元素的质量分数。
(1)碳素钢是铁合金,属于金属材料,故合理选项是B;
(2)①SO2和CO2都能使澄清石灰水变浑浊,但SO2具有漂白性,能使品红溶液褪色,所以要检验CO2必须先排除SO2的干扰,B装置是检验SO2是否除尽,要用品红溶液,装置C的作用是验证X中是否含有CO2;
②装置D中碱石灰作用是吸收产生的CO2,图中装置E中有黑色的CuO粉末,可以用来检验是否有CO,若X中含有CO,E中会发生反应:CO+CuO![]() CO2+Cu,反应产生的Cu单质为红色,生成的二氧化碳气体通入F中,能够使澄清石灰水变浑浊,所以可根据E中黑色固体逐渐变红色,F中澄清石灰水变浑浊来证明X中含有CO;
CO2+Cu,反应产生的Cu单质为红色,生成的二氧化碳气体通入F中,能够使澄清石灰水变浑浊,所以可根据E中黑色固体逐渐变红色,F中澄清石灰水变浑浊来证明X中含有CO;
(3)要确定是否含Fe2+,首先选择非氧化性酸将固体溶解;Fe2+具有还原性,能还原酸性高锰酸钾溶液而使其褪色;另外,Fe2+也可与K3[Fe(CN)6]反应产生蓝色沉淀,来确定固体中是否含有Fe2+,故选用试剂序号为ac;
(4)由题意,X气体中含有二氧化硫,二氧化硫具有还原性,碘单质具有氧化性,两者反应:SO2+I2+2H2O=H2SO4+2HI,I2遇淀粉会变蓝,若恰好反应完全,即Ⅲ中无碘单质,此时溶液恰好由蓝色突变为无色;根据方程式可知关系式:SO2~I2,所以n(SO2)=n(I2)=25×10-3L×0.01 mol/L=2.5×10-4mol,则SO2的体积分数:(2.5×10-4mol×22.4 L/mol)÷0.224 L×100%=2.5%,由于气体X总体积为1.12 L,则原气体中含有CO和CO2的体积1.12 L×(1-2.5%)=1.092 L,根据C元素守恒可知n(C)=![]() =0.04875 mol,m(C)= 0.04875 mol×12 g/mol=0.585 g,所以该碳素钢中碳元素的质量分数为:
=0.04875 mol,m(C)= 0.04875 mol×12 g/mol=0.585 g,所以该碳素钢中碳元素的质量分数为:![]() ×100%=6%。
×100%=6%。