题目内容
(16分)重铬酸铵 [(NH4)2Cr2O7]是一种橘黄色的晶体,常用于石油精炼、制革、印染、烟火、陶瓷等行业,是一种重要的化工原料。
(1)已知在酸性条件下,重铬酸盐有强氧化性。向冷的酸性重铬酸铵溶液中通入H2S,可得到Cr3+和S,写出反应的离子方程式: 。
(2)在150℃时,重铬酸铵迅速呈膨胀式分解,发生如下主要反应:
 |
(NH4)2Cr2O7=Cr2O3+4H2O+N2↑,
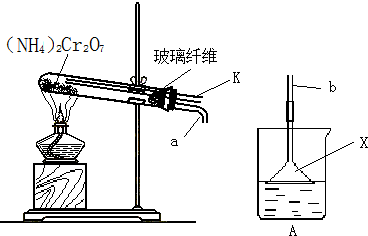
但同时要发生副反应。某同学设计了如下装置,探究副反应的生成物:
①装置中棉花的作用是 ;加热前,该同学先通过导管K向试管中通一会N2,其目的是 ;
②连接a、b,关闭导管K,加热使反应发生。若装置A中所盛溶液为酚酞溶液,且溶液变红,说明有 产生,仪器X的作用是 ;若装置A中所盛溶液为新制的硫酸亚铁溶液,且出现棕红色的沉淀,说明副反应中有 产生,写出产生该沉淀的离子方程式 。
(1)Cr2O72―+3H2S+8H+=2Cr3++3S+7H2O(3分);
(2)①防止粉尘堵塞导管(2分);赶走试管及导管内空气(氧气)(2分);
②NH3(2分);防止因NH3溶解引起的倒吸(2分);
③O2 (2分);
④4Fe2++8OH―+2H2O+O2=4Fe(OH)3↓(3分)。
(或:4Fe2++8NH3?H2O+2H2O+O2=4Fe(OH)3↓+8NH4+)

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目