题目内容
【题目】下列有关电解质溶液的说法正确的是( )
A.向K2S溶液中加水稀释![]() 会减小
会减小
B.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液中:c(Na+)<c(NO3-)
C.取c(H+)=0.01mol·L-1的盐酸和醋酸各1L,分别加入0.3g锌粉,在相同条件下充分反应,盐酸与锌反应的平均速率大
D.向CuS和FeS均饱和的混合溶液中加入少量Na2S固体,![]() 保持不变
保持不变
【答案】D
【解析】
A.K2S溶液中,水解平衡常数Kh=![]() 不变,加水稀释,c(OH-)减小,则
不变,加水稀释,c(OH-)减小,则![]() 增大,故A错误;
增大,故A错误;
B.硝酸钠溶液中Na+、NO3-在滴加盐酸过程中始终以离子状态存在,不发生变化,故c(Na+)=c(NO3-),故B错误;
C.起始时c(H+)相同的盐酸和醋酸,反应速率相同,在反应过程中未电离的醋酸分子还会持续电离出H+,后者的氢离子浓度较大,且锌量不足,故醋酸与锌的反应速率较大,故C错误;
D.溶度积常数不变,则![]() 保持不变,故D正确;
保持不变,故D正确;
故选D。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案【题目】氢气和二氧化碳在一定条件下可合成甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
I、在恒温条件下,分别将2 molCO2和6 mol H2充入一个固定容积为1L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(CH3OH)与反应时间t的关系如下表;
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
n(CH3OH)/mol | 0 | 0.50 | 0.80 | 0.90 | 0.99 | 1.00 | 1.00 |
(1)前10min中利用CO2表示的反应速率为____________。
(2)该温度下,此反应的平衡常数K=__________。
(3)该温度下,若向同容积的另一容器中投入的:CO2、H2、CH3OH、H2O的浓度分别为2 mol·L-1、2 mol·L-1、1 mol·L-1、1 mol·L-1,则此时v正_______v逆(填“>”、“<”或“=”)。
Ⅱ、在密闭容器中充入1molCO2和3 mol H2,测得混合气体中甲醇的体积分数与温度的关系如图A所示:
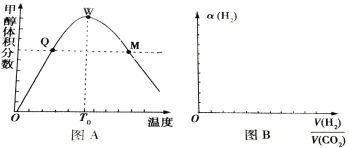
试回答下列问题:
(1)该反应是______(填“放热”或“吸热”)反应。
(2)氢气在Q点的转化率_________(填“大于”、“小于”或“等于”,下同)氢气在W点的转化率;
(3)解释0—T0内,甲醇的体积分数变化趋势:_______________。
(4)图B表示氢气转化率α(H2)与投料比![]() 的关系,请在图B中画出两条变化曲线并标出曲线对应的条件,两条曲线对应的条件分别为:一条曲线对应的压强是1.01×105Pa;另一条曲线对应的压强是3.03×105Pa(其它条件相同)________。
的关系,请在图B中画出两条变化曲线并标出曲线对应的条件,两条曲线对应的条件分别为:一条曲线对应的压强是1.01×105Pa;另一条曲线对应的压强是3.03×105Pa(其它条件相同)________。
【题目】Ⅰ.某温度下,纯水中的c(H+)=2.0×10-7mol·L-1,则此时溶液的c(OH-)=____ mol·L-1,这种水显____(填“酸”“碱”或“中”)性;若温度不变,滴入稀盐酸使c(H+)=5.0×10-6 mol·L-1,则c(OH-)=__ mol·L-1。
Ⅱ. (1)在2mL 0.1mol·L-1的NaCl溶液中,加入2mL 0.1mol·L-1的AgNO3溶液,可观察到____,此反应的离子方程式为______________。 将此混合液过滤,滤渣加入2mL 0.1mol·L-1的KI溶液,搅拌,可观察到_______________, 反应的离子方程式为____________。
(2)下列说法不正确的是___。
A.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小
B.所有物质的溶解都是吸热的
C. 沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全
D.除去溶液中的Mg2+,用OH-沉淀Mg2+比![]() 用效果好,说明 Mg(OH)2的溶解度比MgCO3大
用效果好,说明 Mg(OH)2的溶解度比MgCO3大
Ⅲ. 25 ℃,两种常见酸的电离常数如下表所示。
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-8 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
(1)![]() 的电离常数表达式 K =_____________。
的电离常数表达式 K =_____________。
(2)H2SO3溶液和NaHCO3溶液反应的主要离子方程式为______________。