题目内容
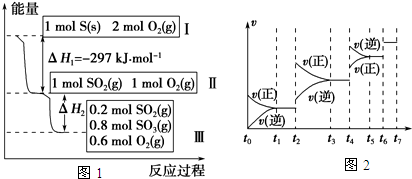
恒温恒容条件下,发生化学反应H2(g)+I2(g)?2HI(g),下列选项中不能作为达平衡标志的是( )
分析:当化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再改变,由此衍生的一些物理量不变,注意该该反应中反应物的化学计量数之和与生成物的化学计量数关系.
解答:解:A.混合气体颜色不再变化,说明各物质的浓度不再发生变化,反应达到平衡状态,故A正确;
B.化学反应速率之比等于化学计量数之比,无论反应是否达到平衡状态,都存在单位时间内生成nmol氢气的同时生成nmol碘蒸气,故B错误;
C.在隔热密闭体积恒定的容器中进行反应,当反应达到平衡状态时,温度不变,故C正确;
D.2V正(H2)=V逆(HI),说明正逆反应速率相等,反应达到平衡状态,故D正确.
故选B.
B.化学反应速率之比等于化学计量数之比,无论反应是否达到平衡状态,都存在单位时间内生成nmol氢气的同时生成nmol碘蒸气,故B错误;
C.在隔热密闭体积恒定的容器中进行反应,当反应达到平衡状态时,温度不变,故C正确;
D.2V正(H2)=V逆(HI),说明正逆反应速率相等,反应达到平衡状态,故D正确.
故选B.
点评:本题考查化学平衡状态的判断,题目难度不大,本题注意把握化学平衡状态的特征,把握判断平衡状态的标志.

练习册系列答案
相关题目
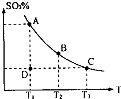 (1)在硫酸生产中,SO2催化氧化生成SO3是反应的关键,其反应的化学方程式为:2SO2(g)+O2(g)?2SO2(g),反应混合体系SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题:
(1)在硫酸生产中,SO2催化氧化生成SO3是反应的关键,其反应的化学方程式为:2SO2(g)+O2(g)?2SO2(g),反应混合体系SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题: