题目内容
【题目】近期发现,H2S是继NO、CO之后第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
(1)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为________________、______________,制得等量H2所需能量较少的是_____________(填“系统(Ⅰ)”或“系统(Ⅱ)”)。
(2)羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。H2S与CO2在高温下发生反应:H2S(g)+CO2(g)![]() COS(g) +H2O(g)。在610 k时,将1 mol CO2与1 mol H2S充入2 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
COS(g) +H2O(g)。在610 k时,将1 mol CO2与1 mol H2S充入2 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
①H2S的平衡转化率![]() =_______%,反应平衡常数K=________。
=_______%,反应平衡常数K=________。
②在620 K重复试验,平衡后水的物质的量分数为0.03,H2S的转化率![]() _____
_____![]() ,该反应的
,该反应的![]() H_____0。(填“>”“<”或“=”)
H_____0。(填“>”“<”或“=”)
③向反应器中再分别充入下列气体,能使H2S转化率增大的是________(填标号)
A.N2 B.H2S C.COS D.CO2
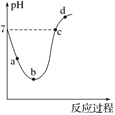
(3)25℃,在0.10mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-) 关系如右图(忽略溶液体积的变化、H2S的挥发)。

①pH=13时,溶液中的c( H2S ) + c( HS- )=_____mol·L-1。
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH=______时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13 ]
【答案】 H2O(l)=H2(g)+1/2O2(g) ΔH=+286 kJ/mol H2S(g)=H2(g)+S(s) ΔH=+20 kJ/mol 系统(II) 4 1.7×10-3 > > D 0.043 5
【解析】(1)本题考查热化学反应方程式的计算,系统I中三式相加,得到H2O(l)=H2(g)+1/2O2(g) △H=(327-151+110)kJ·mol-1=+286kJ·mol-1,系统II三式相加得到H2S(g)=H2(g)+S(s) △H=(-151+110+61)kJ·mol-1=+20kJ·mol-1,根据系统I和系统II的的热化学反应方程式,产生等量氢气,系统II需要的能量最少;(2)考查化学平衡的计算、勒夏特列原理,① H2S(g)+CO2(g)![]() COS(g) +H2O(g)
COS(g) +H2O(g)
起始: 1 1 0 0
变化: x x x x
平衡: 1-x 1-x x x 水的物质的量分数为x/2=0.02,解得x=0.04mol,即H2S的转化率为0.04/1×100%=4%,依据化学平衡常数的表达式,K= =1.7×10-3;②620K时的水的物质的量分数为0.03大于610K时的水的物质的量分数,说明升高温度,平衡向正反应方向移动,H2S的转化率增大,即α1>α2,根据勒夏特列原理,正反应是吸热反应,即△H>0;③A、N2为非反应气体,容器为恒容装置,因此增加N2的量,化学平衡不移动,H2S的转化率不变,故A错误;B、增加H2S的量,虽然平衡向正反应方向进行,但H2S的转化率降低,故B错误;C、增加COS的量,增加生成物的浓度,平衡向逆反应方向进行,H2S的转化率降低,故C错误;D、增加CO2的量,平衡向正反应方向移动,H2S转化率增大,故D正确;(3)本题考查物料守恒、溶度积的计算,①根据物料守恒c(H2S)+c(HS-)+c(S2-)=0.10mol·L-1。pH=13时,根据图像,c(S2-)=5.7×10-2mol·L-1,则c( H2S ) + c( HS- )=(0.1-5.7×10-2)mol·L-1=0.043mol·L-1;②根据溶度积的表达式,因此有c(S2-)=Ksp/c(Mn2+)=2.8×10-13/0.02mol·L-1=1.4×10-11mol·L-1,根据图像,此时对应的pH=5,当pH=5时,Mn2+开始出现沉淀。
=1.7×10-3;②620K时的水的物质的量分数为0.03大于610K时的水的物质的量分数,说明升高温度,平衡向正反应方向移动,H2S的转化率增大,即α1>α2,根据勒夏特列原理,正反应是吸热反应,即△H>0;③A、N2为非反应气体,容器为恒容装置,因此增加N2的量,化学平衡不移动,H2S的转化率不变,故A错误;B、增加H2S的量,虽然平衡向正反应方向进行,但H2S的转化率降低,故B错误;C、增加COS的量,增加生成物的浓度,平衡向逆反应方向进行,H2S的转化率降低,故C错误;D、增加CO2的量,平衡向正反应方向移动,H2S转化率增大,故D正确;(3)本题考查物料守恒、溶度积的计算,①根据物料守恒c(H2S)+c(HS-)+c(S2-)=0.10mol·L-1。pH=13时,根据图像,c(S2-)=5.7×10-2mol·L-1,则c( H2S ) + c( HS- )=(0.1-5.7×10-2)mol·L-1=0.043mol·L-1;②根据溶度积的表达式,因此有c(S2-)=Ksp/c(Mn2+)=2.8×10-13/0.02mol·L-1=1.4×10-11mol·L-1,根据图像,此时对应的pH=5,当pH=5时,Mn2+开始出现沉淀。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案【题目】下列各组物质中,满足表中图示物质在通常条件下能一步转化的全部组合是
序号 | X | Y | Z | W |
|
Al | NaAlO2 | Al(OH)3 | Al2O3 | ||
② | Na | NaOH | Na2CO3 | NaCl | |
③ | C | CO | CO2 | H2CO3 | |
④ | Fe | FeCl3 | FeCl2 | Fe(OH)2 |
A. ①② B. ①③④ C. ②③ D. ①④
【题目】从实验测得不同物质中氧—氧之间的键长和键能的数据如下表:
O—O键 数据 | O | O | O2 | O |
键长/10-12m | 149 | 128 | 121 | 112 |
键能/kJ·mol-1 | x | y | z=494 | w=628 |
其中x、y的键能数据尚未测定,但可根据规律性推导键能的大小顺序为w>z>y>x。该规律性是( )
A. 成键时电子数越多,键能越大 B. 键长越短,键能越大
C. 成键所用的电子数越少,键能越小 D. 成键时电子对越偏移,键能越大