题目内容
【题目】工业生产以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:
2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(l)
CO(NH2)2(l)+H2O(l)
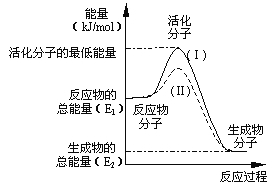
(1)在密闭容器中充入NH3和CO2 ,一定条件能自发进行的原因是__________________
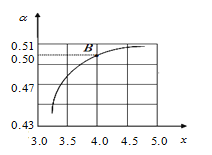
(2)T1℃时,在2 L的密闭容器中充入NH3和CO2模拟工业生产,若原料气中的NH3和CO2的物质的量之比(氨碳比)![]() =x,如图是CO2平衡转化率(α)与氨碳比(x)的关系。其它条件不变时,α随着x增大而增大的原因是 ;
=x,如图是CO2平衡转化率(α)与氨碳比(x)的关系。其它条件不变时,α随着x增大而增大的原因是 ;
(3)当x=2,上述反应至5min时各物质的浓不再发生变化,若起始的压强为P0 KPa,测得平衡体系压强变为起始时的![]() 。反应结束后,分离得到90g尿素。
。反应结束后,分离得到90g尿素。
试计算该反应的平均速率v(CO2)= ,
该反应的平衡常数(K)=____ _,
达到平衡后NH3的物质的量浓度为 ,
【答案】(8分)①虽然△S<0,使反应不自发,但△H<0使反应自反且影响程度大。(或△G<0,
或其他合理解释)(1分②x增大,相当于c(NH3)增大,CO2转化率增大(2分)
③0.15mol*L-1;Kp=22.8/P03h或0.074;;3mol*L-1(5分)
【解析】
试题解析: (1)2NH3(g)+CO2(g) ![]() CO(NH2)2(l)+H2O(l) △H<0; △S<0,△H<0;低温下使反应自发
CO(NH2)2(l)+H2O(l) △H<0; △S<0,△H<0;低温下使反应自发
进行;(2) 原料气中的NH3和CO2的物质的量之比(氨碳比)![]() =x,x越大相当于加入的氨气的量越多;两种反应物,增加氨气的浓度,平衡右移,二氧化碳的转化率增大;
=x,x越大相当于加入的氨气的量越多;两种反应物,增加氨气的浓度,平衡右移,二氧化碳的转化率增大;
(3)2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(l)
CO(NH2)2(l)+H2O(l)
起始: 2a a 0 0
变化: 2x x 1.5
平衡 2 a -2x a -x 1.5
分离得到90g尿素。尿素的量为1.5摩尔;
压强之比等于物质的量之比:P0 /2 P0/3=(2+1)a / (2 a -2x)+ (a -x); x=1.5 解之得出a=4.5
v(CO2)=1.5/2/5=0.15mol*L-1; 该反应的平衡常数(K)=1/(2 a -2x)2×(a –x),带入数值,解之
Kp=22.8/P03 h;达到平衡后NH3的物质的量浓度为(2 a -2x)/2;带入数值,解之为3mol*L-1
考点:反应自发进行的条件、转化率的判断、速率的计算、平衡常数的计算等。

 黄冈创优卷系列答案
黄冈创优卷系列答案