题目内容
v L Fe2(SO4)3溶液中含有a g SO42-,取此溶液0.5v L,用水稀释至2v L,则稀释后溶液中Fe3+的物质的量浓度为
A.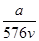 mol·L-1 mol·L-1 | B.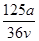 mol·L-1 mol·L-1 |
C.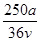 mol·L-1 mol·L-1 | D.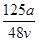 mol·L-1 mol·L-1 |
A
试题分析:SO42-的物质的量为
 ,SO42-的浓度为
,SO42-的浓度为 ,Fe3+的浓度为
,Fe3+的浓度为 ×
× =
=
取
 ,即Fe3+物质的量为
,即Fe3+物质的量为 ,稀释成2V后浓度变为
,稀释成2V后浓度变为 ÷2V=
÷2V=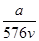 ,因此答案为A。
,因此答案为A。
练习册系列答案
相关题目

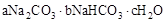 (a、b、c为整数)表示。现有A、B两种不同的天然碱样品,分别进行如下实验以确定其化学式。
(a、b、c为整数)表示。现有A、B两种不同的天然碱样品,分别进行如下实验以确定其化学式。
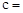
 NaCl+NaHCO3 NaHCO3+HCl
NaCl+NaHCO3 NaHCO3+HCl