题目内容
下列性质的递变中,正确的是( )
| A、O、S、Na的原子半径依次增大 |
| B、HF、NH3、SiH4的稳定性依次增强 |
| C、LiOH、KOH、CsOH的碱性依次增强 |
| D、HCl、HBr、HI的还原性依次减弱 |
考点:微粒半径大小的比较,金属在元素周期表中的位置及其性质递变的规律,非金属在元素周期表中的位置及其性质递变的规律
专题:元素周期律与元素周期表专题
分析:A.同周期元素,随原子序数增大,原子半径减小;同主族自上而下原子半径增大;
B.元素的非金属性越强,对应的氢化物越稳定;
C.元素的金属性越强,对应的最高价氧化物的水化物的碱性越强;
D.元素的非金属性越强,对应的氢化物的还原性越弱.
B.元素的非金属性越强,对应的氢化物越稳定;
C.元素的金属性越强,对应的最高价氧化物的水化物的碱性越强;
D.元素的非金属性越强,对应的氢化物的还原性越弱.
解答:
解:A.同周期元素,随原子序数增大,原子半径减小,所以原子半径Na>S;同主族自上而下原子半径增大,所以原子半径S>O,所以原子半径Na>S>O,故A正确;
B.非金属性F>N>Si,元素的非金属性越强,对应的氢化物越稳定,故B错误;
C.金属性Cs>K>Li,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,故C正确;
D.非金属性Cl>Br>I,元素的非金属性越强,对应的氢化物的还原性越弱,故D错误.
故选AC.
B.非金属性F>N>Si,元素的非金属性越强,对应的氢化物越稳定,故B错误;
C.金属性Cs>K>Li,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,故C正确;
D.非金属性Cl>Br>I,元素的非金属性越强,对应的氢化物的还原性越弱,故D错误.
故选AC.
点评:本题考查元素周期律的递变,为高频考点,侧重于学生的分析能力的考查,题目难度不大,本题注意把握元素周期律与元素周期表的关系,注意相关规律、方法的掌握.

练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目
下列物质互为同分异构体的一组是( )
| A、12 C和14 C |
| B、O2和O3 |
| C、H2O和H2O2 |
| D、丁烷和异丁烷 |
在下列溶液中一定能大量共存的离子组是( )
| A、水电离产生的c(H+)=1×10-12mol/L溶液:NH4+、Na+、Cl-、NO3- |
| B、能使pH试纸变深蓝色的溶液中:Na+、AlO2-、S2-、CO32- |
| C、含有大量Fe3+的溶液:SCN-、I-、K+、Br- |
| D、溶液中:Fe3+、CO32-、Al3+、SO42- |
某物质含有极性共价键,则下列说法不正确的是( )
| A、可能含有离子键 |
| B、可能是无机物或有机物 |
| C、可能是单质或化合物 |
| D、不可能是金属晶体 |
下列递变情况中不正确的是( )
| A、HF、HCl、HBr、HI的沸点依次升高 |
| B、硅、磷、硫、氯元素的最高正化合价依次升高 |
| C、O2-、F-、Na+、Mg2+的离子半径依次增大 |
| D、锂、钠、钾、铷的金属性依次增强 |
下列关于物质“反应程度”的说法正确的是( )
| A、一定条件下,2mol SO2与足量O2反应可得到2mol SO3 |
| B、含4mol HCl的浓盐酸与足量的MnO2加热反应可制备1mol Cl2 |
| C、10mL 18.0mol/L H2SO4与足量铜加热反应可制备0.09mol SO2 |
| D、一定条件下,1mol N2与3mol H2反应可制备1.0mol NH3 |
“绿色化学”提倡化工生产应尽可能将反应物的原子全部利用,从根本上解决环境污染问题.在下列制备环氧乙烷的反应中,最符合“绿色化学”思想的是( )
A、CH2=CH2+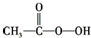 (过氧乙酸)→ (过氧乙酸)→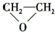 +CH3COOH +CH3COOH | ||
B、CH2=CH2+Cl2+Ca(OH)2→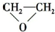 +CaCl2+H2O +CaCl2+H2O | ||
C、2CH2=CH2+O2
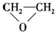 | ||
D、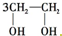
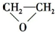 +HOCH2CH2-O-CH2CH2OH+2H2O +HOCH2CH2-O-CH2CH2OH+2H2O |