题目内容
D、E、X、Y、Z是周期表中的前20号元素,且原子序数逐渐增大.它们的简单氢化物分子的空间构型依次是正四面体、三角锥形、正四面体、角形(V形)、直线形.回答下列问题:
(1)Y的最高价氧化物的化学式为 ;
(2)上述5种元素中,能形成酸性最强的含氧酸的元素是 ,写出该元素的任意3种含氧酸的化学式: ;
(3)D和Y形成的化合物,其分子的空间构型为 ;
(4)D 和X形成的化合物,其化学键类型属 ,其晶体类型属
(5)金属镁和E的单质在高温下反应得到的产物是 ,此产物与水反应生成两种碱,该反应的化学方程式是 ;
(6)试比较D和X的最高价氧化物熔点的高低并说明理由: .
(1)Y的最高价氧化物的化学式为
(2)上述5种元素中,能形成酸性最强的含氧酸的元素是
(3)D和Y形成的化合物,其分子的空间构型为
(4)D 和X形成的化合物,其化学键类型属
(5)金属镁和E的单质在高温下反应得到的产物是
(6)试比较D和X的最高价氧化物熔点的高低并说明理由:
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:D、E、X、Y、Z是短周期元素,且原子序数逐渐增大,它们的最简单氢化物分子的空间结构依次是正四面体、三角锥形、正四面体、角形(V形)、直线型,形成正四面体结构的氢化物是CH4、SiH4,形成三角锥型的氢化物是NH3、PH3,形成V型的氢化物是H2O、H2S,形成直线型结构的氢化物是HCl、HF,这几种元素的原子序数逐渐增大,所以D的氢化物是CH4,E的氢化物是NH3,X的氢化物是SiH4,Y的氢化物是H2S,Z的氢化物是HCl,则D、E、X、Y、Z分别是C、N、Si、S、Cl元素,据此答题.
解答:
解:D、E、X、Y、Z是短周期元素,且原子序数逐渐增大,它们的最简单氢化物分子的空间结构依次是正四面体、三角锥形、正四面体、角形(V形)、直线型,形成正四面体结构的氢化物是CH4、SiH4,形成三角锥型的氢化物是NH3、PH3,形成V型的氢化物是H2O、H2S,形成直线型结构的氢化物是HCl、HF,这几种元素的原子序数逐渐增大,所以D的氢化物是CH4,E的氢化物是NH3,X的氢化物是SiH4,Y的氢化物是H2S,Z的氢化物是HCl,则D、E、X、Y、Z分别是C、N、Si、S、Cl元素.
(1)Y是S元素,其最高价氧化物的化学式是SO3,
故答案为:SO3;
(2)元素非金属性越强,其对应的最高价含氧酸的酸性越强,在C、N、Si、S、Cl五种元素中Cl元素的非金属性最强,对应的最高价含氧酸的酸性最强.该元素对应的含氧酸为HClO、HClO2、HClO3、HClO4;
故答案为:Cl;HClO、HClO3、HClO4;
(3)D和Y形成的化合物是CS2,其分子的空间构型和二氧化碳的相同,为直线型,
故答案为:直线型;
(4)D和X形成的化合物为SiC,通过共价键形成原子晶体;
故答案为:共价键;原子晶体;
(5)镁和氮气反应生成Mg3N2,氮化镁与水反应生成两种碱,分别是氢氧化镁和氨气,所以该反应的化学方程式Mg3N2+6H2O═3Mg(OH)2+2NH3↑,
故答案为:Mg3N2;Mg3N2+6H2O═3Mg(OH)2+2NH3↑;
(6)D和X的最高价氧化物分别为CO2和SiO2,因为CO2是分子晶体,SiO2是原子晶体,故SiO2的熔点高于CO2;
故答案为:CO2是分子晶体,SiO2是原子晶体.
(1)Y是S元素,其最高价氧化物的化学式是SO3,
故答案为:SO3;
(2)元素非金属性越强,其对应的最高价含氧酸的酸性越强,在C、N、Si、S、Cl五种元素中Cl元素的非金属性最强,对应的最高价含氧酸的酸性最强.该元素对应的含氧酸为HClO、HClO2、HClO3、HClO4;
故答案为:Cl;HClO、HClO3、HClO4;
(3)D和Y形成的化合物是CS2,其分子的空间构型和二氧化碳的相同,为直线型,
故答案为:直线型;
(4)D和X形成的化合物为SiC,通过共价键形成原子晶体;
故答案为:共价键;原子晶体;
(5)镁和氮气反应生成Mg3N2,氮化镁与水反应生成两种碱,分别是氢氧化镁和氨气,所以该反应的化学方程式Mg3N2+6H2O═3Mg(OH)2+2NH3↑,
故答案为:Mg3N2;Mg3N2+6H2O═3Mg(OH)2+2NH3↑;
(6)D和X的最高价氧化物分别为CO2和SiO2,因为CO2是分子晶体,SiO2是原子晶体,故SiO2的熔点高于CO2;
故答案为:CO2是分子晶体,SiO2是原子晶体.
点评:本题考查元素及其化合物的性质、分子空间构型等知识点,题目难度中等,明确常见分子的空间构型是解本题的关键,侧重于基础知识的应用的考查.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列各组离子能大量共存的是( )
| A、Cu2+、NO3-、Cl-、K+ |
| B、Fe3+、SO4-、SCN-、Na+ |
| C、Al3+、K+、AlO2-、Cl- |
| D、Fe2+、NO3-、Cl-、H+ |
为了鉴定溴乙烷中溴元素的存在,试分析①~⑥的各步实验,其中操作顺序合理的是( )①加入AgNO3溶液 ②加入NaOH溶液 ③加热 ④加入蒸馏水 ⑤用HNO3酸化溶液⑥加入NaOH溶液醇溶液.
| A、①②③⑤ | B、②③⑤① |
| C、⑥③⑤① | D、④②⑤③ |
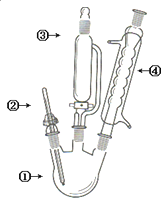 高中化学选修5《有机化学基础》第64页,有这样一个有机合成的装置图,有关下列仪器的名称和作用的叙述不正确的是( )
高中化学选修5《有机化学基础》第64页,有这样一个有机合成的装置图,有关下列仪器的名称和作用的叙述不正确的是( )| A、①三口烧瓶,用作反应器 |
| B、②为温度计,用于测量反应混合物的温度 |
| C、③为长颈漏斗,用于反应过程中添加反应液体 |
| D、④球形冷凝管,起冷凝、回流的作用,其冷水的进口在下方 |
下列物质能发生加成,加聚和缩聚反应的是( )
| A、C6H5-OH |
B、 |
| C、CH2=CH-COOH |
| D、HO-CH2-CH=CH-CH2-CH3 |








