题目内容
下列有关反应的离子方程式不正确的是
- A.向Ba(OH)2溶液中加入少量NaHSO3溶液:HSO3-+Ba2++OH-═BaSO3↓+H2O
- B.向Na2CO3溶液中滴入酚酞溶液,溶液变红:CO32-+2H2O?H2CO3+2OH-
- C.足量的铁溶于少量的稀硝酸:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O
- D.向AgCl悬浊液中加入KI溶液振荡,出现黄色沉淀:AgCl(S)+I-?AgI(S)+Cl-
分析:A、碱和酸式盐反应,量少的全部反应,离子方程式中符合化学式的组成比;
B、碳酸钠溶液中碳酸根离子是多元弱酸阴离子,分步水解呈碱性;
C、足量铁反应生成亚铁离子,依据电荷守恒和原子守恒判断;
D、碘化银的溶解度小于氯化银.可以实现沉淀转化;
解答:A、向Ba(OH)2溶液中加入少量NaHSO3溶液:HSO3-+Ba2++OH-═BaSO3↓+H2O,故A正确;
B、向Na2CO3溶液中滴入酚酞溶液,溶液变红,碳酸根离子是多元弱酸阴离子,分步水解呈碱性:CO32-+H2O?HCO3-+OH-;HCO3-+H2O?H2CO3+OH-;故B错误;
C、足量的铁溶于少量的稀硝酸,反应的离子方程式:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O,故C正确;
D、向AgCl悬浊液中加入KI溶液振荡,出现黄色沉淀,碘化银溶解度小于氯化银,实现沉淀转化,反应的离子方程式:AgCl(S)+I-?AgI(S)+Cl-,故D正确;
故选B.
点评:本题考查了离子方程式的书写方法和注意问题,注意酸式盐和碱反应量不同产物不同,沉淀转化判断,氧化还原反应的产物判断,题目难度中等.

(14分)在现代生活中,人们越来越注意微量元素的摄入。碘元素对人体健康有着至关重要的作用。为预防碘缺乏病,我国卫生部规定每千克食盐中应含有40~50mgKIO3。下表是某超市出售的加碘精制盐的有关说明:
产品标准 | GB5461 2000 |
配料表 | 氯化钠、碘酸钾、抗结剂 |
氯化钠含量 | ≥98.5% |
含碘量(以I计) | 20~50mg/kg |
储藏方法 | 密闭、避光、防潮 |
食用方法 | 待食品熟后加入 |
包装日期 | 见打印批号 |
某同学设计实验验证此食盐中是否含碘和检查该食盐是否为合格产品。
(1)完成下列实验报告:
实验步骤 | 实验现象 | 实验结论(步骤2用离子方程式表示) |
1.取食盐少许于一支试管中,加入适量的蒸馏水,振荡。 | 固体完全溶解 | 食盐及碘酸钾都能溶于水 |
2.向上述溶液中滴加适量的亚硫酸氢钠溶液,振荡 | 溶液出现棕黄色 |
|
3.再向上述溶液中滴加淀粉溶液,振荡 | 溶液变成蓝色 |
|
(2)加碘食盐的包装袋上标有食用方法:待食品熟后加入。其原因是:
(3)该同学取该食盐样品100.0g完全溶解于水中,然后加入用盐酸酸化的淀粉―KI溶液,结果溶液呈蓝色,则反应的离子方程式为 。
为进一步确证样品是否为合格产品,该同学又用0.010mol?L-1的Na2S2O3溶液滴定,当用去12.00mL时蓝色刚好褪去(反应方程式为I2+2S2O2-3=2I-+S4O2-6),通过计算核加碘食盐中KIO3的含量为 mg/kg。由此可判定该食盐为 (填“合格”或“不合格”)产品。
(4)KIO3可用电解的方法制得,原理是:以石墨为阳极,以不锈钢为阴极,在一定温度和电流下电解KI溶液。总反应方程式为KI+3H2O ===== KIO3+3H2↑,则阳极的电极反应式为 ;阴极附近pH值 (填“增大”、“减小”、“不变”)
 氢气是一种清洁能源,可以通过多种方法制得.
氢气是一种清洁能源,可以通过多种方法制得.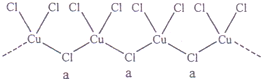

 s) + H2O(g)
s) + H2O(g)  CO(g) + H2(g) △H> 0
CO(g) + H2(g) △H> 0