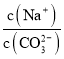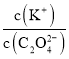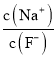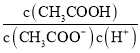题目内容
【题目】设NA为阿伏加德罗常数,下列说法不正确的是
A. 1mol O2与金属钠反应,O2不一定得到4NA个电子
B. 标准状况下,a L CH4和a L C6H14中所含分子数均为![]()
C. 常温常压下,1mol氯气与足量的金属镁反应,转移2NA个电子
D. 在20℃、1atm时,2.8g C2H4和CO的混合气体含气体分子数等于0.1 NA
【答案】B
【解析】
A. 1mol O2与金属钠反应,可能生成氧化钠或者过氧化钠,故O2不一定得到4NA个电子,A正确;
B. 标准状况下, C6H14为非气态,故无法计算其分子数,B错误;
C. 常温常压下,1mol氯气与足量的金属镁反应,生成氯化镁,转移2NA个电子,C正确;
D. 在20℃、1atm时,C2H4和CO的摩尔质量均为28g/mol,故其混合气体的平均摩尔质量也为28g/mol,2.8g C2H4和CO的混合气体含气体分子数等于0.1 NA,D正确;
故答案选B。

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目
【题目】下列实验中“实验内容”与对应“现象或结论”关系都正确的是
选项 | 实验内容 | 实验现象或结论 |
A | 分别往4 mL 0.1 mol/L 、4 mL 0.2 mol/L KMnO4溶液加入2 mL 0.1 mol/L H2C2O4溶液,记录褪色时间 | 浓度越大,反应速率越快越先褪色 |
B | 25℃时,向pH=1的盐酸和醋酸各0.5L的溶液中各加入1.4g铁粉 | 醋酸中生成H2的速率快且最终气体量多 |
C | 以石墨为电极,电解KI溶液(其中含有少量酚酞) | 阴极逸出气体且附近溶液呈现红色 |
D | 向FeCl3+3KSCN | 血红色变浅,说明增加生成物浓度,平衡逆向移动 |
A. A B. B C. C D. D