题目内容
【题目】水合肼(N2H4·H2O)是无色、有强还原性的液体,实验室制备水合肼的原理为:CO(NH2)2+2NaOH+ NaClO=Na2CO3+N2H4·H2O+NaCl。据此,某学生设计了下列实验。
I、制备 NaClO溶液
实验装置如下图图甲所示(部分夹持装置已省略)
已知:3NaClO![]() 2NaCl+NaClO3
2NaCl+NaClO3
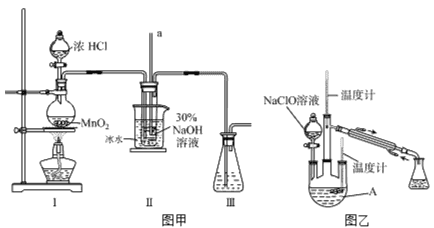
(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外还有______________(填字母)。
A.容量瓶 B.烧杯 C.移液管 D.玻璃棒
(2)装置I中发生的离子反应方程式是_____________________________。
Ⅱ、制取水合肼
实验装置如上图图乙所示
(3)反应过程中,如果分液漏斗中溶液的滴速过快,部分N2H4·H2O参与A中反应并产生大量氮气,产品产率因此降低,请写出降低产率的相关化学反应方程式________________________________;充分反应后,加热蒸馏A内的溶液即可得到水合肼的粗产品。
(4)称取馏分0.3000g,加水配成20.0mL溶液,一定条件下用0.1500mol·L-1的I2溶液滴定。
已知:N2H4·H2O +2I2=N2↑+4HI+H2O
①滴定时,可以选用的指示剂为____________________;
②实验测得消耗I2溶液的平均值为20.00L,馏分中N2H4·H2O的质量分数为____________________。
【答案】 BD MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 2NaClO+N2H4·H2O=2NaCl+N2↑+3H2O 淀粉溶液 25%
Mn2++Cl2↑+2H2O 2NaClO+N2H4·H2O=2NaCl+N2↑+3H2O 淀粉溶液 25%
【解析】I、制备 NaClO溶液
装置中:二氧化锰与浓盐酸反应制取氯气,制取的氯气中含有氯化氢,装置Ⅱ中玻璃管a的作用为平衡压强,氯气与氢氧化钠反应制备NaClO,Ⅱ中用冰水浴控制温度在30℃以下,防止NaClO (歧化)分解为氯酸钠和氯化钠,装置Ⅲ进行尾气处理。
(1)根据配制一定质量分数的溶液的步骤选用仪器;
(2)二氧化锰与浓盐酸反应生成氯化锰、氯气与水;
Ⅱ、制取水合肼
(3) N2H4·H2O具有强还原性,容易被过量的NaClO氧化;
(4)①碘溶液遇淀粉变蓝色,肼反应完全,再滴入碘的标准溶液后,溶液变蓝色;
②根据方程式N2H4·H2O +2I2=N2↑+4HI+H2O计算。
详解:(1)配制30%NaOH溶液时,用天平称量质量,在烧杯中加水溶解,并用玻璃棒搅拌,需要玻璃仪器有:烧杯、玻璃棒,
因此,本题正确答案是:BD;
(2)二氧化锰与浓盐酸反应生成氯化锰、氯气与水,反应离子方程式为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O,
Mn2++Cl2↑+2H2O,
因此,本题正确答案是:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(3) N2H4·H2O具有强还原性,容易被过量的NaClO氧化,会发生反应:2NaClO+N2H4·H2O=2NaCl+N2↑+3H2O,
因此,本题正确答案是:2NaClO+N2H4·H2O=2NaCl+N2↑+3H2O;
(4)①碘的标准溶液与肼反应完全,再滴入碘的标准溶液后,遇淀粉变蓝色,实验滴定终点的现象为:溶液出现蓝色且半分钟内不消失,所以选择淀粉为指示剂,
因此,本题正确答案是:淀粉溶液;
②设馏分中水合肼(N2H4·H2O)的质量分数为a,则:
N2H4·H2O +2I2=N2↑+4HI+H2O
50g 2mol
0.3000g×a 0.020L×0.15mol/L
所以50g: 0.3000g×a=2mol: 0.020L×0.15mol/L,计算得出:a=25%,
因此,本题正确答案是:25%。